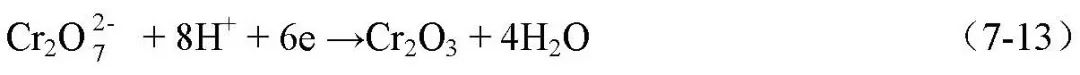選材、腐蝕試驗及腐蝕控制 緩蝕劑評價與使用 1 緩蝕劑的分類 緩蝕劑保護是通過添加少量能阻止或減緩金屬腐蝕速度的物質,即緩蝕劑,以防止或減緩金屬腐蝕的方法。不但對金屬的全面腐蝕可采用緩蝕劑保護,對應力腐蝕、孔蝕、縫隙腐蝕、晶間腐蝕和腐蝕疲勞等也可采用緩蝕劑保護。緩蝕劑可以是單組分物質,或者多組分,用量很少,雖然它不能改變金屬在介質中的腐蝕傾向,但它能在金屬表面形成保護膜,從而抑制金屬的腐蝕,減緩金屬的腐蝕速度;多種緩蝕劑的配合使用,還可以同時保護與腐蝕介質接觸的多種金屬材料。緩蝕劑還可以和涂料、電化學保護等聯合使用。 緩蝕劑保護的特點是藥劑直接投加到腐蝕系統,設備和操作簡單、一次投資少,收效快。采用合適的緩蝕劑及保護工藝,保護效率可達99%~100%。緩蝕劑不僅可有效地減緩金屬的腐蝕,有時在保護金屬的機械強度、加工性能以及改善生產環境、降低原料消耗上也有一定的效果。廣泛應用于石油、化工、鋼鐵、機械、航空航天、動力和運輸部門,是重要的防腐蝕方法之一,主要用于腐蝕性為中等或較輕的系統的中長期保護,或對某些強腐蝕介質的短期保護。如,美國阿波羅登月計劃中,在N2O4介質中加入少量H2O或NO,解決了鈦合金制容器的應力腐蝕問題,既是緩蝕劑應用的典型案列。 緩蝕劑的品種繁多,常用的如亞硝酸鈉、鉻酸鹽、磷酸鹽、石油磺酸鋇、亞硝酸二環已胺等,至今尚難以有統一的分類方法。常見到的分類方法有以下幾種。 01 按緩蝕劑作用的電化學理論分類 a.陽極型緩蝕劑 也稱陽極抑制型緩蝕劑,是通過抑制腐蝕的陽極過程而阻滯金屬腐蝕的物質。這種緩蝕劑通常是由其陰離子向金屬表面的陽極區遷移,它們能增加陽極極化,從而使腐蝕電位正移。氧化金屬使之鈍化,從而阻滯陽極過程。例如,中性介質中的鉻酸鹽與亞硝酸鹽。一些非氧化型的緩蝕劑,例如苯甲酸鹽、正磷酸鹽、硅酸鹽等在中性介質中,只有與溶解氧并存,才起到陽極抑制劑的作用。該類緩蝕劑屬于“危險型”緩蝕劑,鈍化劑的緩蝕率很高,但用量必須足夠。否則,導致腐蝕加速或發生孔蝕。 作用過程為: i.具有強氧化作用的緩蝕劑,使金屬鈍化,主要有亞硝酸鈉,高鉻酸等; ii.具有陰極去極化性的鈍化劑,在陰極被還原,加大陰極電流,使體系的氧化還原電位向正方移動,超過鈍化電位,而使腐蝕電流達到很低的值。主要有亞硝酸鹽、硝酸鹽與高價金屬鹽,鉻酸鹽、磷酸鹽、鉬酸鹽、鎢酸鹽等在酸性溶液中。 鉻酸鹽有很強的氧化能力,發生氧化反應時Cr6+還原為Cr3+,鉻酸鹽在較高濃度時是十分有效的陽極鈍化劑。鉻酸鹽對碳鋼的鈍化與碳鋼在H2SO4 中的電位極化相似,鈍化時鐵表面發生的反應為: 反應時被還原的鉻酸鹽以Cr2O3 的形態吸附在鐵的表面和鐵表面同時生成的Fe2O3 共同組成鈍化膜。鈍化膜充分脫水,結構致密,防腐性能好。而其它緩蝕劑處理鐵都無法得到這樣的膜,甚至用KMnO4 強氧化劑也不能達到鉻酸鹽鈍化鐵的這種程度。 鉻酸鹽對鋼鐵和銅、鋅、鋁及其合金都能給予良好的保護作用,適用pH值范圍寬(pH6~11),使用鉻酸鹽作緩蝕劑時,碳鋼的腐蝕速度可低于0.025 mm·a-1。鉻酸鹽的缺點是毒性大,環境保護部門對鉻酸鹽的排放有嚴格的要求,容易被還原而失效,不宜用于有還原性物質的煉油廠的冷卻系統中; b.陰極型緩蝕劑 通過抑制腐蝕的陰極過程而阻滯金屬腐蝕的物質。這種緩蝕劑通常是由其陽離子向金屬表面的陰極區遷移,或者被陰極還原,或者與陰離子反應而形成沉淀膜,使陰極過程受到阻滯,增大酸性溶液中氫析出的過電位,使腐蝕電位向負移動。例如聚磷酸鹽、ZnSO4、Ca(HCO3)2、As3+、Sb3+可以分別和OH-生成Zn(OH)2、Ca(OH)2沉淀或被還原為As、Sb覆蓋在陰極表面,以阻滯腐蝕。此類緩蝕劑是“安全型緩蝕劑”。 作用過程為: i.成膜型陰極緩蝕劑,腐蝕過程在陰極生成的OH-與緩蝕劑反應生成的不溶性物質使金屬表面形成膜層,阻礙陰極反應。如硫酸鋅,碳酸氫鈣及鎂,錳等鋼鐵緩蝕劑; ⅱ.提高陰極反應過電位的緩蝕劑。此類緩蝕劑的作用在于增大腐蝕電池的陰極極化,使陰極反應速度降低,從而減小金屬的腐蝕。如,增加H+放電過電位的緩蝕劑,硫化物和在酸性溶液中砷離子、銻離子等在金屬表面析出時,提高了H+放電的過電位而抑制H+的還原反應。這類化合物可能導致金屬的氫損傷(氫鼓泡、氫脆等) ⅲ.陰極去極化型緩蝕劑。加入了陰極緩蝕劑后,只改變了陰極反應過程,而陽極反應不發生變化。如亞硝酸鹽; ⅳ.除氧劑型緩蝕劑。這類緩蝕劑可以在腐蝕介質中可以消耗其中的氧氣,從而降低陰極反應速度。這類緩蝕劑有亞硫酸鈉、肼等還原劑。如肼與氧反應: N2H4+O2→N2+2H2O (7-14) c.混合型緩蝕劑 這種緩蝕劑既可抑制陽極過程,又可抑制陰級過程。如含氮、含硫以及既含氮含硫的有機化合物、瓊脂、生物堿,硅酸鈉,鋁酸鈉等。 金屬在腐蝕介質中的腐蝕電位>零電荷電位時,金屬表面帶正電荷,易吸附陰離子型緩蝕劑;金屬在某腐蝕介質中的腐蝕電位<零電荷電位時,金屬表面帶負電荷,易吸附陽離子型緩蝕劑;金屬在某腐蝕介質中的腐蝕電位接近零電荷電位時,金屬表面幾乎沒有電荷,易吸附中性分子緩蝕劑。 02 成分分類 a.無機緩蝕劑,如亞硝酸鹽、硝酸鹽;鉻酸鹽、重鉻酸鹽;磷酸鹽、多磷酸鹽;硅酸鹽;鉬酸鹽;含砷化和物等。無機緩蝕劑多半是使金屬生成不溶性鈍化膜層或反應膜層(苯甲酸鈉與無機緩蝕劑作用相似)來阻止腐蝕; b.有機緩蝕劑,有機緩蝕劑大多含氮或硫,或者二者都有。如,有機硫化合物(硫醇、硫醚、硫脲及其衍生物等)、胺和胺鹽、醛類、炔醇類、有機磷化合物、羧酸及其鹽類;磺酸及其鹽類;雜環化合物等。有機緩蝕劑大部分主要是吸附在金屬表面,改變金屬表面的狀態而起緩蝕作用; 03 緩蝕劑所形成保護膜的特征分類 a.鈍化膜型緩蝕劑 通過使金屬表面形成致密的、附著力強的氧化膜而阻滯金屬腐蝕的物質。例如,鉻酸鹽、重鉻酸鹽、亞硝酸鈉等。由于它們具有鈍化作用,故又稱為鈍化劑。氧化膜型緩蝕劑必須具備兩個條件,即氧化電位足夠高(熱力學),氧化還原反應速度要足夠快(動力學)。 該緩蝕劑能直接或間接氧化金屬,成膜厚度5~10nm,一般對可鈍化的金屬具有良好的保護作用。而對銅、鋅等金屬效果較差或沒有效果,也可能是促進腐蝕; b.沉淀膜型緩蝕劑 能與介質中的有關離子反應并在金屬表面生成有一定保護作用的沉淀膜,從而阻滯金屬腐蝕的物質。可以分為陽極型和陰極型。陽極型的有磷酸鹽、硼酸鹽、硅酸鹽、苯甲酸鹽等。陰極型的主要有Ca、Mg、Zn、Mn、Ni的鹽類,如Ca(HCO3)2、ZnSO4等。成膜厚度幾十到幾百nm,多孔。沉淀型緩蝕劑常也是“安全緩蝕劑”,用量不足不會增加金屬的腐蝕。但沉淀型緩蝕劑的沉淀膜與金屬的結合力較差,保護效果一般不如鈍化劑,緩蝕效果較差,并可能造成結垢; c.吸附膜型緩蝕劑 能吸附在金屬表面形成吸附膜從而阻滯金屬腐蝕的物質。多為有機物,因有機緩蝕劑都含有極性基團和非極性基團。根據吸附機理不同,可分為物理吸附(如胺類、硫醇和硫脲等)和化學吸附型(如吡啶衍生物,苯胺衍生物,環狀亞胺等)兩類,在酸性介質中效果較好。吸附機理可用軟硬酸堿理論來解釋,硬酸與硬堿形成物理吸附,軟酸與軟堿形成化學吸附。該類緩蝕劑對金屬表面清潔度要求較高,與不潔凈的金屬表面吸附不好,影響緩蝕效果。 i.物理吸附。緩蝕劑在金屬表面的吸附源于緩蝕劑離子和金屬表面的靜電引力和范德華力,其中靜電引力起到重要作用,這種吸附迅速、可逆,其吸附熱小,受溫度影響大。 物理吸附型多數屬于陰極型緩蝕劑,該類緩蝕劑的分子往往是由極性基團和非極性基團組成,分子結構對吸附的影響首先取決于極性基團和非極性基團的性質,極性基團中含有電負性高的O、N、P、S等元素,非極性基團主要是C、H元素。其中極性基團是親水性的,可吸附于金屬表面活性點或整個表面。而非極性基團是疏水或親油的,將金屬表面和腐蝕介質隔開; ⅱ.化學吸附。化學吸附是指緩蝕劑分子中極性基團中心原子的未共用電子對和金屬形成配價鍵而引起吸附。 供電子型有機緩蝕劑分子中,含有以O、N、S、P為中心原子的極性基團,這些原子具有未共用的孤對電子,具有一定的供電子能力。緩蝕劑中的雙鍵、三鍵上的鍵類似于孤對電子,也有提供電子的能力。緩蝕劑和金屬兩者可以形成配位反應而發生化學吸附,該吸附具有明顯的吸附選擇性,化學吸附多為抑制陽極反應,過程為不可逆。緩蝕劑的分子結構會影響化學吸附作用,受溫度影響小。 供質子型緩蝕劑 當極性基團中的中心原子吸引相鄰H上的電子時,會使H上的電子偏向中心原子,使H類似于帶正電荷的質子一樣,這樣氫就可以和金屬表面多電子的陰極區發生吸附作用。 04 緩蝕劑的用途分類 可分為冷卻水、油氣井、酸洗、氣相緩蝕劑等。 05 緩蝕劑的溶解特性分類 a.水溶性緩蝕劑 如亞硝酸鹽、磷酸鹽、苯甲酸鹽、1-羥基苯駢三氮唑等;工業用水緩蝕劑方面,聚丙烯衍生物(聚丙烯酸、聚丙烯酰胺等)、含磷有機酸聚合物(POCA)在工業冷卻水中具有較好的阻垢、緩蝕等多功能作用。 聚乙烯吡咯烷酮及聚乙烯亞胺等高分子聚合物可以作為磷酸中低碳鋼的緩蝕劑。果膠(P)、羧甲基纖維素(PEG)、聚乙烯醇(PVA)、聚乙二醇(PEG)、聚丙烯酸(PAA)、聚丙烯酸鈉(Na-PAA)等高分子聚合物在不同的酸溶液中緩蝕效果有明顯的差別,但其共同點是對生態環境不會造成不良影響。 防銹水即是水溶性的緩蝕劑與各種輔劑(消泡、增稠、浸潤等)的水溶液,通常用于短期的工序間防銹; b. 油溶性緩蝕劑 油溶性緩蝕劑,如石油磺酸鋇、十二烯基丁二酸等;油溶性緩蝕劑分子結構的特點是不對稱性,一般由極性和非極性的兩個基團構成。常見的極性基團有-OH、-COOH、-SO3H、-NH2等,它們與金屬、水具有很強的親和力;非極性基團主要是烴基,具有親油憎水性。因此,當油溶性緩蝕劑與金屬接觸時,會發生緩蝕劑分子在油-金屬界面的定向吸附。主要類型有: 羧酸及其皂類(RCOOH及(RCOO)N·Mm):有硬脂酸、油酸、蓖麻油、棕櫚酸、環烷酸、氧化石油及氧化地臘、烯基丁二酸、壬基苯氧基醋酸、羥基脂肪酸等。羧酸皂的防銹效果比相應的酸性強,故皂類常用于封存油品。 酯類(RCOOR):蜂蠟、羊毛脂,酯類緩蝕劑在高溫下易氧化變質。 胺類及其它含氮化合物:胺類有三乙醇胺、單乙醇胺、尿素等,含氮化合物有苯并三唑、哌啶等。 磺酸鹽及其它含硫化合物:石油磺酸鹽、石油磺酸的鈉皂、鋇皂和鈣皂都可以用作油溶性緩蝕劑。巰基苯并噻唑、烷基磺酸鈉等。 磷酸酯及其它含磷化合物:常見有酸性磷酸酯、酸性亞磷酸酯及硫代磷酸酯等。 防銹油即為基礎油脂+油溶性緩蝕劑+輔劑組成的,國內常用的油溶性緩蝕劑有石油磺酸鋇、二壬基萘磺酸鋇、十二烯基丁二酸、氧化石油脂及其皂類、硬脂肪鋁、環烷酸鋅、羊毛脂及其皂類、苯并三唑、咪唑啉衍生物等。輔劑指抗氧化、助溶、消泡、抗熔、抗凝固以及提高低溫附著力的助劑。 作用機理有兩種理論,膜理論理論認為,緩蝕劑分子吸附在金屬表面后,會與金屬發生化學反應,生成難溶于水的鈍化膜(相膜),從而阻滯了腐蝕電池的電極過程。如銅緩蝕劑苯并三氮唑(BTA)即屬于該類。吸附理論分為物理吸附和化學吸附,當在金屬表面涂敷防銹油之后,便迅速形成了3層吸附膜防護層,即在油-金屬界面上的緩蝕劑分子定向排列的吸附層,與緩蝕劑分子非極性尾相互交溶而垂直向外的有序排列的油分子層,以及緩蝕劑分子在氣-油界面上的一層單分子吸附膜。 c.氣相緩蝕劑 氣相緩蝕劑,即揮發性緩蝕劑,能在常溫下自動揮發出氣體,依靠它所揮發的緩蝕分子或緩蝕基團在金屬表面作用,從而阻止金屬銹蝕或降低金屬大氣腐蝕速度。其作用機理是氣化以后,和空氣中的濕氣一起凝結在金屬表面,形成液膜。 氣相緩蝕劑具有經濟、有效、干凈、清潔的特點,由于氣體是無孔不入的,所以無論是金屬制品的表面,還是內腔、溝槽甚至縫隙部位均可得到保護。氣相緩蝕劑使用時不必直接接觸金屬表面,特別適合于結構復雜的金屬制品與構件的非涂裝性保護,主要作為氣相防銹包裝材料應用于金屬制品的儲存和運輸。 為了使氣相緩蝕劑能有效發揮作用,使用空間應當是封閉的。氣相緩蝕劑的應用方式很多,如,將氣相緩蝕劑粉末裝入布袋內或直接散布于機械設備的不同部位;將制成不同形狀的片、丸、錠劑;還可以制成氣相防銹紙、氣相防銹液、氣相防銹油。 氣相緩蝕劑應當有比較大的蒸汽壓,容易揮發充滿金屬設備所在空間。有機二胺或多胺化合物作是通過阻止金屬腐蝕的陽極過程來減緩腐蝕。有機胺分子量較小且有較高的飽和蒸氣壓,在一定條件下容易揮發,在金屬表面形成一種保護膜,或者能與酸性氣體發生反應,從而抑制金屬的氣相腐蝕。而且,緩蝕劑的穩定性能很好,不因光、熱等因素的影響而降低緩蝕劑性能,即使空氣濕度增加。 氣相緩蝕劑主要種類有: i.機酸與有機酸的銨鹽。如苯甲酸銨、碳酸銨、亞硝酸二環己胺、亞硝酸二異丙基胺等。它們主要是鋼鐵的緩蝕劑,少數對Cu、Al也有緩蝕作用; ⅱ.基化合物及其胺鹽。如硝基甲烷、間硝基苯酚、α-硝基氮茂等。主要適合于黑色與有色金屬的緩蝕劑; ⅲ.酯類。如鄰苯二甲酸二丁酯、己二酸二丁酯和醋酸異戊酯等; ⅳ.混合型。如亞硝酸鈉+磷酸氫二銨+碳酸氫鈉、亞硝酸鈉+苯甲酸銨、亞硝酸鈉+烏洛托品、亞硝酸鈉+尿素等,適用于黑色金屬。 有機胺均有很大毒性,因為揮發性大,氣相緩蝕劑在排放過程中很難處理,容易被人體吸入,使用受到限制。氨基酸具有無毒、易分解特點,是氣相緩蝕劑的發展方向。 06 金屬材料的品種分類 分為黑色金屬(如亞硝酸鹽、鉬酸鹽、胺等)、銅(如苯并三氮唑、2-巰基苯并噻唑等)、鋁(如硫脲、硅酸鹽等)、不銹鋼(如CdSO4、CaSO4等)緩蝕劑等。 07 介質的酸堿性分類 分為酸性介質、中性介質和堿性介質緩蝕劑。 a.中性介質中的緩蝕劑 是指在pH值為6-8的水溶液中使用的緩蝕劑。該類緩蝕劑是水溶性的。常見的有聚磷酸鹽、鉻酸鹽、硅酸鹽、碳酸鹽、亞硝酸鹽、苯并二氮唑、2-巰基苯并噻唑、亞硫酸鈉、氨水、肼、環己胺、烷基胺、苯甲酸鈉等。 亞硝酸鈉適用于黑金屬,但不能用于銅等有色金屬; 三乙醇胺與油酸作用后可作為乳化劑,用于配制乳化切削液,也用于氣相防銹劑。 六次甲基四胺(烏洛托品)與其他水溶性防銹劑配合使用。 苯甲酸鈉可與其他緩蝕劑配合使用。 b.酸性介質中的緩蝕劑 一般酸性介質緩蝕劑均屬于吸附型緩蝕劑,該類緩蝕劑一般用于金屬除銹及除氧化皮的酸洗過程中,故稱酸洗緩蝕劑。該類緩蝕劑的作用是在酸溶解金屬上的氧化皮、銹蝕產物的同時,抑制酸對金屬基體的溶解。常用的酸性介質緩蝕劑有二鄰甲苯基硫脲,主要用于黑色金屬酸洗,但有促進滲氫的危險;烏洛托品適用于硫酸、鹽酸除銹液,對降低滲氫有效,緩蝕效率較高;若丁,鄰二甲苯基硫脲、糊精、氯化鈉、皂角粉的混合物,用于黑色金屬。KC緩蝕劑,動物蛋白及其水解產物,對鋼鐵在硫酸中有緩蝕效果。 c.堿性介質中的緩蝕劑 常溫條件下, 在NaOH、Na2CO3、氨水等稀堿溶液中, 一般金屬(除鋁、鉛、錫等兩性金屬外)的腐蝕速率很低。然而在環境溫度升高、堿溶液濃度增加時, 則有可能產生明顯的腐蝕過程。此外, 當堿溶液中有溶解氧存在時,銅及銅合金的腐蝕進程加劇。為此,針對不同的金屬材料和介質開發了在堿性環境下使用的緩蝕劑以解決金屬材料在堿性環境下的全面腐蝕、點蝕和應力腐蝕等。如,稀NaOH(質量分數2-3%)溶液中,可采用向介質中通入H2S的方法抑制海軍黃銅腐蝕;糖類有機化合物可抑制氨水對銅及銅合金的腐蝕。
免責聲明:本網站所轉載的文字、圖片與視頻資料版權歸原創作者所有,如果涉及侵權,請第一時間聯系本網刪除。

官方微信
《腐蝕與防護網電子期刊》征訂啟事
- 投稿聯系:編輯部
- 電話:010-62316606
- 郵箱:fsfhzy666@163.com
- 腐蝕與防護網官方QQ群:140808414