摘要
綜述了鐵還原菌 (IRB) 對海洋中鋼鐵等材料腐蝕影響的國內外研究進展。闡述了IRB種類和代謝方式的多樣性,介紹了其在代謝過程中的電子傳遞方式;總結了海水環境中IRB所致金屬腐蝕機理的研究現狀,分析了不同研究者的結論存在差異的原因;最后介紹了研究IRB腐蝕影響常用的方法,并對今后的研究方向提出相應的建議。
關鍵詞: 海水腐蝕; 微生物腐蝕; 鐵還原菌; 異化鐵還原
根據我國自然資源部發布的《2018年中國海洋經濟統計公報》,2018年的全國海洋生產總值已達83415億元,占國內生產總值的9.3%,航運業以及海洋相關產業已經成為當今經濟發展的重要引擎。海洋環境復雜多變,高濃度的鹽、溶解氧等因素共同作用造成海洋工程材料的嚴重腐蝕,帶來巨大經濟損失,埋下許多安全隱患。其中,微生物如細菌、真菌、古菌等在海洋裝備災難性事故中扮演的角色引起人們越來越多的關注。這種由于微生物生命活動或代謝產物所導致的腐蝕稱為微生物腐蝕 (MIC)。
海洋中已經報道的微生物約有1500多種,具有腐蝕活性的微生物主要有硫酸鹽還原菌 (SRB)、硝酸鹽還原菌 (NRB)、鐵氧化菌 (IOB)、鐵還原菌 (IRB) 和產酸菌 (APB) 等[1],其主要通過參與Fe、S等的循環并改變金屬表面的陰、陽極反應影響腐蝕過程[2-4]。自然環境下,金屬的MIC往往伴隨著生物膜的生成和發展,生物膜可以為微生物提供適合的生存環境,對殺菌劑起到屏障作用,且生物膜不同深度溶解氧、無機鹽、有機營養成分等的濃度不同,為微生物之間的協同作用提供有利環境。MIC的控制在很大程度上是生物膜的控制[5,6]。SRB由于廣泛存在于無氧環境,造成嚴重的腐蝕后果,被認為是最重要的腐蝕微生物。因此,MIC理論大多是以SRB為研究對象提出的,如經典的陰極去極化理論、濃差電池理論、代謝產物腐蝕理論等。而Jia等[6,7]在前人的基礎上通過分析SRB、APB等微生物在金屬腐蝕過程中的能量和電子傳遞過程,提出胞外電子傳遞理論 (EET-MIC)、代謝產物腐蝕理論 (M-MIC) 和生物降解腐蝕理論 (BD-MIC) 的劃分,進一步完善了MIC理論。IRB作為海洋環境中一類重要的微生物,其對金屬材料的腐蝕影響研究相對較少,有待進一步探索。
地球上的生命活動及進化與各類元素的循環息息相關,其中Fe作為地殼中含量第四位的元素,參與地球上大部分的生命代謝活動。現今的地球表面是一個固、液、氣三相組成的高度異質環境,Fe主要以氧化態Fe(Ⅲ) 形式存在,但Fe(Ⅲ) 組成的礦物質或化合物溶解度極低,生物難以直接吸收。20世紀80年代以前,人們認為S的還原是微生物還原最早的形式,直到1987年分離并培養出第一株具有鐵還原功能的細菌,人們開始意識到微生物還原Fe(Ⅲ) 可能是地球早期生命的呼吸方式之一,Vargas等[8]也通過實驗證明了幾種嗜熱菌相比S更易還原Fe(Ⅲ)。近年來,隨著不同種類的IRB被陸續從海水、海泥甚至深海熱液區等水域環境中分離提取,其對金屬材料的腐蝕作用也引起人們的關注[9]。雖然IRB對金屬材料的腐蝕影響已取得一些成果,但對其作用結果及作用機制存在爭議。因此,深入系統地探究IRB所致金屬的腐蝕機制不僅可以進一步豐富MIC理論,還對海洋工程裝備的防護具有理論指導意義。
本文從IRB種類的多樣性、代謝過程的多樣性、對金屬材料的腐蝕機制研究現狀、腐蝕研究方法等幾個方面總結了海水環境中IRB所致金屬材料腐蝕的研究進展。
1 海水環境中IRB種類的多樣性
IRB并不是一個分類學上的概念,而是一類可以將Fe(Ⅲ) 還原為Fe(Ⅱ) 的微生物統稱。Fe(Ⅲ) 的還原也稱為異化鐵還原,微生物通過氧化電子供體獲得電子,以胞外Fe(Ⅲ) 作為末端電子受體,將Fe(Ⅲ) 還原為Fe(Ⅱ),同時獲得能量[10]。IRB是一類嚴格厭氧或兼性厭氧的細菌或古菌,生存環境廣泛,常見的海水環境中存在的IRB種類如表1所示。其中,深海熱液區是重要的含鐵氧化物的儲存區,為異化IRB的生存繁殖提供了電子受體。但是,由于當前的技術限制,熱液區的樣品不易獲取,并且外部條件改變后菌株不易存活,因此對深海熱液區的IRB研究報道較少。目前在金屬腐蝕領域研究最多的是Shewanella和Geobacter。
表1 海水環境已知的部分IRB種類
2 IRB代謝過程的多樣性
微生物在代謝過程中需要不斷地與外界進行物質交換,攝取能量,同時排出代謝產物,其本質是一系列的氧化還原反應,即存在電子供體和電子受體的電子傳遞過程。IRB從電子供體中獲得電子,再將電子傳遞給Fe(Ⅲ) 使其還原,在此過程中獲得并儲存能量,有些IRB也可以還原其他有毒重金屬和類金屬,將還原過程作為自身的一種解毒機制[24]。
2.1 電子供體
IRB可利用H2、有機酸作為電子供體,尤其是短鏈有機酸,如乳酸鹽、乙酸鹽、甲酸鹽,琥珀酸等;Geoglobus ahangari、Desulfuromonas palmitatis以及Geothrix fermentans可以利用一些長鏈脂肪酸如硬脂酸、棕櫚酸等;還有少數幾種可以利用葡萄糖和芳香族化合物作為電子供體,其中利用葡萄糖獲得能量時大多通過發酵路徑,產生乙酸。除此以外,極端環境分離的超嗜熱菌如Ferroglobus placidus還能在一定條件下以Fe(Ⅱ) 為電子供體[25]。
2.2 電子受體
IRB在代謝過程中除了以Fe(Ⅲ) 作為電子受體,兼性厭氧的IRB在有氧環境下還能以O2為電子受體,Mn(Ⅳ)、胞外苯醌類化合物、富馬酸、含氯化合物、硝酸根等也在一定條件下也可以作為IRB的電子受體[26-28]。其中,Shewanella、Acidiphilium以及Rhodoferax在利用O2作為電子受體時比Fe(III) 生長更好,這是因為在中性或偏堿性pH值環境下Fe(III) 的溶解度和氧化還原電位都比較低,微生物利用O2呼吸可產生更多的能量。在酸性條件下Fe(III) 以Fe3+的形式存在,Fe3+的氧化還原電位與O2接近,可同時利用O2和Fe(III) 進行呼吸。
此外,根據呼吸類型,可以分為呼吸型IRB和發酵型IRB。其中,呼吸型IRB可以通過完全或不完全氧化有機物獲取電子,再傳遞給電子受體,獲取并儲存能量,如Geobacter、Desulfuromonas可以完全將有機物氧化成CO2,而Shewanella、Pseudomonas不能將有機物完全氧化為CO2。發酵型IRB通過發酵有機物獲取能量并進行異化鐵還原,但是大部分電子儲存在發酵代謝產物中,只有極少部分的電子用來還原Fe(Ⅲ),如Vibrios和Bacillus等。研究者們通過計算表明,少量Fe(Ⅲ) 可以促進發酵獲取更多能量[29,30]。因此,呼吸型的IRB更易對金屬腐蝕產生影響。
2.3 電子傳遞機制
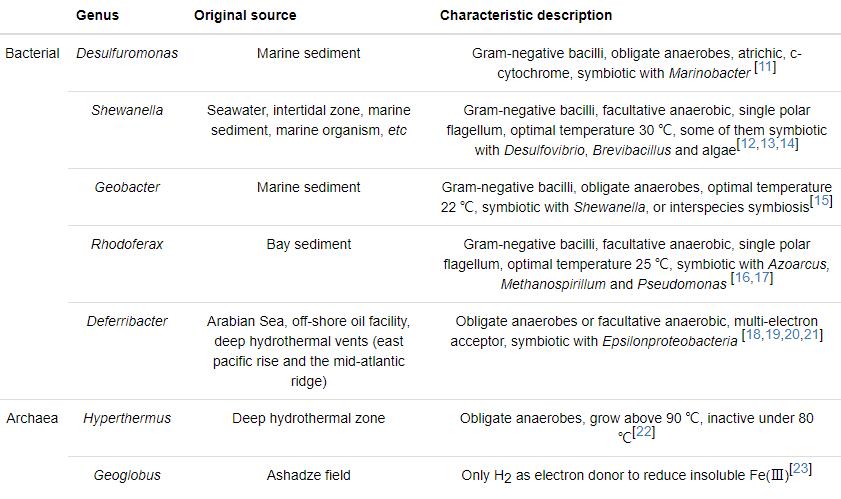
IRB是通過向胞外轉移電子的代謝方式實現電子傳遞過程。目前普遍認為,IRB通過以下幾種機制傳遞電子 (見圖1):(a) 直接接觸機制:細菌以菌毛作為納米導線或通過外膜上的活性蛋白,直接接觸鐵氧化物表面釋放電子;(b) 電子穿梭機制:微生物分泌的氧化還原物質攜帶電子傳遞至胞外受體,再以氧化態返回胞內繼續接受電子,如此往返于胞內外的介質;(c) 鰲合作用機制:微生物分泌出復雜的有機配位體與不溶性鐵氧化物作用形成可溶性復合體,溶解性的Fe通過擴散作用到微生物表面,增大微生物與Fe(Ⅲ) 的接觸效率,提高鐵還原速率[31]。在實際環境中,這幾種機制的貢獻還不是很清楚。例如,Geobacter不能產生電子穿梭體及絡合物,通常被認為主要是通過膜蛋白或產生鞭毛進行電子傳遞[32];而Shewanella能分泌電子穿梭體或螯合物,比如醌、有機配位基、黑色素等,直接接觸可能就不作為其還原不溶性鐵氧化物的主要途徑[33,34]。
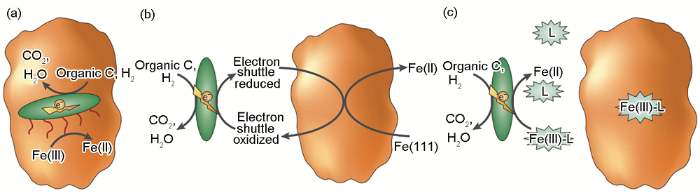
圖1 微生物作用于Fe(Ⅲ) 氧化物表面傳遞電子的3種方式[31]
3 IRB對金屬材料腐蝕的影響
金屬在海水環境中的腐蝕過程大多是電化學過程,以鋼鐵的腐蝕為例,腐蝕過程中必定伴隨著Fe的溶解,電極反應中的陽極反應為:
![]()
在有氧環境下,陰極反應很容易發生,O2迅速將Fe2+氧化為Fe3+,生成鐵的氧化物或氫氧化物。而在無氧環境下,電子傳遞給H2O電解的H+,電極反應為[5,35]:

當微生物參與到腐蝕過程中時,其生長代謝會通過不同的途徑改變電化學過程,例如微生物生命活動分泌能夠促進陰極還原的酶而影響電極反應的動力學過程。生物膜結構創造生物膜內部的腐蝕微環境,如降低膜內溶解氧、生成抗菌素、分泌緩蝕劑等,改變金屬與體系接觸的表面狀態,從而改變金屬的腐蝕速率[5,36,37]及新陳代謝產物的腐蝕作用。IRB對金屬的腐蝕影響近年來取得一系列研究成果。
3.1 單一IRB作用下的腐蝕過程
3.1.1 腐蝕促進理論
IRB引起金屬材料腐蝕促進的MIC理論可總結為以下幾方面:(1) 被廣泛接受的腐蝕產物保護膜破壞理論。在一定條件下,鋼鐵表面形成的腐蝕產物膜對材料起到一定的保護作用,而IRB能夠將保護性的Fe(III) 氧化物還原為可溶性的Fe(II),使得金屬在腐蝕環境中呈現出新鮮的表面,加速金屬腐蝕,其腐蝕機理如圖2。上個世紀80年代,Obuekwe等[38]在微厭氧環境下研究了一株IRB (Pseudomonas sp.) 對碳鋼腐蝕的影響,證明了IRB能夠還原和移除由Fe(III) 化合物組成的保護性膜,促進陽極反應,進而加速碳鋼腐蝕。之后,Little等[39]采用電化學噪聲法研究了另外一株IRB (Shewanella purefaciens) 對碳鋼腐蝕的影響,結果也表明IRB在碳鋼表面通過將固態Fe(III) 的氧化物還原為可溶性的Fe(II),促進碳鋼的腐蝕。(2) 局部腐蝕促進理論。IRB可形成不均勻生物膜,影響電化學過程,為局部腐蝕提供了條件,整體上表現為碳鋼腐蝕被加速[36]。Chen等[40]采用絲束電極 (WBE) 的方法結合生物膜的形貌表征研究了一株IRB (Thalassospira. sp.) 在氧飽和海水中所致Q235碳鋼局部腐蝕的動態過程,結果表明IRB的存在生成了不均勻的生物膜,且IRB在生物膜內的代謝導致了表面膜的局部破壞,產生了電化學活性位點,促進了Q235碳鋼電荷轉移過程。(3) 氫氧化腐蝕促進理論。隨著電化學技術的發展,微區電化學技術已經在腐蝕領域得到越來越廣泛的應用,因此有研究者研究了IRB和H2存在下碳鋼的局部腐蝕[41,42],證明了IRB的氫氧化會使碳鋼在短期內腐蝕加劇。
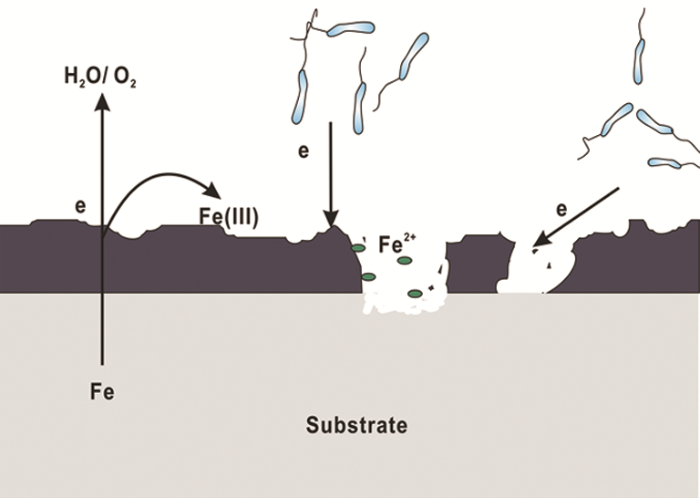
圖2 IRB引起的腐蝕促進機理圖
3.1.2 腐蝕抑制理論
隨著對IRB腐蝕作用研究的深入,越來越多的研究結果表明,IRB對金屬材料起到腐蝕抑制作用,其原因可以總結為以下幾點:(1) O2消耗腐蝕抑制理論。IRB的存在會直接或間接地消耗O2,抑制陰極反應從而抑制材料的腐蝕[43]。O2在金屬腐蝕過程中起到重要作用,其氧化還原電位大于Fe(III)的,使得一些兼性IRB更傾向以O2作為電子受體以獲得更多的能量;同時,被還原生成的Fe(II) 氧化進一步消耗O2,降低體系中的溶解氧,腐蝕機理模型見圖3。(2) 保護性產物層腐蝕抑制理論。近期研究表明,一些IRB會誘導生成具有緩蝕性的保護層如藍鐵礦,從而抑制腐蝕。Cote等[44]認為Geobacter sulfurreducens以醋酸鹽為碳源將Fe(III) 還原為Fe(II),而Fe (II) 與磷酸根結合生成磷酸亞鐵 (Fe3(PO4)2·8H2O) 即藍鐵礦,沉積在碳鋼表面,減少碳鋼的腐蝕。Volkland等[45]也利用IRB在鋼表面成功制備了藍鐵礦涂層,反應如下:
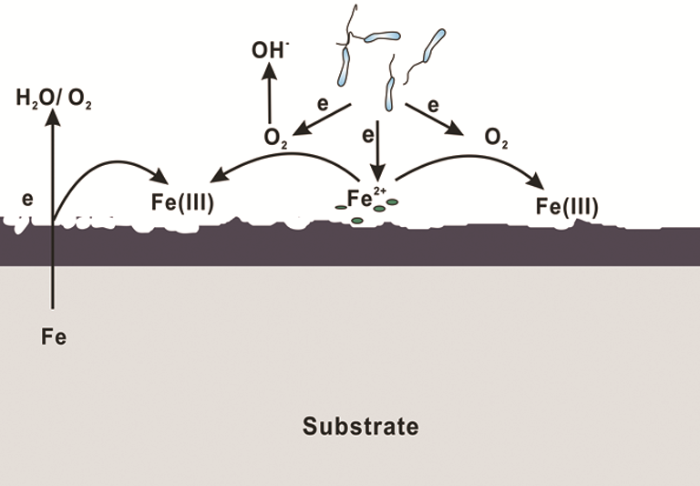
圖3 IRB引起的腐蝕抑制機理圖
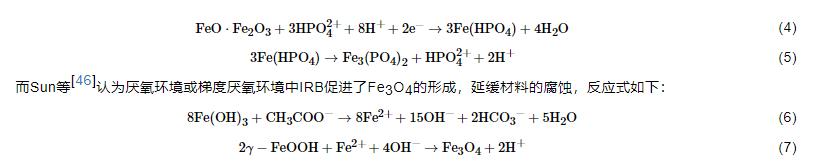
(3) 生物膜腐蝕抑制理論。微生物若在金屬表面生成均勻的生物膜,則會對金屬材料起到保護作用,因為均勻的生物膜屏蔽了O2的向內擴散,有些IRB在生物膜內的代謝還會產生緩蝕劑,抑制腐蝕[37,47]。(4) 電子傳遞腐蝕抑制理論。有研究[48]證明,如果IRB通過納米導線傳遞電子,該過程中會產生陰極電流,抑制腐蝕。
3.2 混合菌作用下的腐蝕過程
實際的海水環境是復雜多樣的,MIC在多數情況下是不同微生物協同作用的結果。除了單一菌種,混合菌即兩種及以上的菌種作用下金屬的腐蝕行為也開始受到關注。其中,有研究者報道了IRB與IOB、銅綠假單胞菌等協同作用對金屬腐蝕的影響。
IOB是常見的一類具有腐蝕活性的微生物,代謝過程中通過將Fe(II) 氧化成Fe(III) 獲取能量,導致在金屬表面產生氧濃差電池,引起局部腐蝕,腐蝕結果往往是在管道等金屬表面形成銹瘤[49],銹瘤又為腐蝕性的厭氧微生物提供厭氧條件,從而造成金屬嚴重的腐蝕。當IRB與IOB同時存在于體系中時,IOB以O2為電子受體,將Fe(II) 氧化成為Fe(III)。而IRB利用生成的Fe(III) 作為電子受體進行還原,但一些種類的IRB也傾向于以O2為電子受體,與IOB形成競爭。因此,二者的共同作用對金屬腐蝕的影響值得探究。IRB與IOB的協同作用在淡水環境如自來水管道等方面研究較多。Wang等[50-52]的一系列研究證實,IRB與IOB通過在金屬管道的內層和外層形成致密的腐蝕產物膜如α-FeOOH和Fe3O4等抑制管道的腐蝕。海水環境中其協同作用對腐蝕過程的影響研究較少。其中,Lee等[53]和Chen等[54]分別研究了不同種類的IRB和IOB混合菌作用對碳鋼腐蝕的影響,結果均表明在有氧環境中IRB的加入會降低體系中O2含量,從而抑制陰極反應的進行,緩解IOB的腐蝕作用。
銅綠假單胞菌也是一種常見的微生物,廣泛存在于各類環境中。Black等[55]在微好氧條件下,研究了低碳鋼中銅綠假單胞菌和IRB共存的腐蝕效應,認為IRB去除保護性鐵氧化物的能力導致銅綠假單胞菌進一步引起陽極極化導致腐蝕加速。
3.3 IRB影響腐蝕復雜性的原因剖析
IRB對海洋工程裝備材料的腐蝕作用是不容忽視的,而現有的研究成果存在爭議的主要原因可以概括為以下兩點:
(1) IRB是一類具有鐵還原能力的微生物,種類繁多,分布在不同的水域環境,因此,不同種類的IRB代謝過程中對電子受體和電子供體的選擇不同。其中O2是一個影響IRB電子受體選擇的重要因素,其氧化還原電位高于Fe(III),理論上有氧條件下兼性IRB趨向以O2作為電子受體,消耗體系中的O2,抑制腐蝕;而無氧條件下,IRB原則上以Fe(III) 等金屬氧化物為電子受體,破壞腐蝕產物保護膜,可能會造成腐蝕加速。因此,不同種類的IRB在不同環境下對電子受體的選擇不同,就會造成結果上的差異,很難進行系統對比。
(2) 生物膜的形成是一個非常復雜的生物/化學過程,對腐蝕過程的影響很難預測和控制,其組成受環境中微小擾動 (如溫度、營養濃度和流量) 的影響,生物膜的狀態會造成材料腐蝕的較大差異。現代的科學技術雖然已經在電化學檢測、生物膜檢測等方面得到了很大的改善,但生物膜內部的微環境如溶解氧、酸堿度、離子種類等還未能實現精確的跟蹤檢測。
4 IRB腐蝕影響的研究方法
4.1 腐蝕過程與產物測試
4.1.1 失重法
失重法測量腐蝕速率是一種簡單可靠的方法。在IRB腐蝕影響的研究過程中,失重法被廣泛應用。打磨后的樣品在置于腐蝕體系中之前稱重,浸泡一定的時間后,根據標準方法除去樣品表面的生物膜及腐蝕產物后再稱重,前后重量差值即為失重量。利用失重法可以得到一個直觀、相對準確的腐蝕速率,但耗時較長且不易得到動態變化過程[6]。
4.1.2 電化學方法
相較于失重法,利用電化學手段研究IRB對金屬表面腐蝕過程熱力學和動力學過程的影響,可以得到快速準確的測試結果,是傳統失重等方法不可比擬的。電化學阻抗譜 (EIS) 測試技術是研究金屬腐蝕最常用的方法之一,該技術對被測體系擾動小,即使擾動信號長時間作用于電極,也不會給被測電極表面造成大的影響。極化曲線測量是腐蝕電化學研究的重要手段,線性極化 (LPR) 對研究電極在腐蝕電位附近外加電流進行微極化,通常選用相對開路電位±10 mV的掃描范圍以最大限度接近體系的真實狀態,通過計算電位對電流的斜率得到極化電阻 (Rp),可表征金屬腐蝕速率;而通過Tafel極化得到的腐蝕電流 (icorr),不僅可以分析電極表面物質傳輸及腐蝕機理,還可以換算得到直觀的腐蝕速率。
利用傳統的電化學手段測試得到的是電極整體的電化學行為,不能提供某一微小區域的狀態,微區電化學測試技術應運而生,彌補了普通電化學的不足。例如,局部電化學阻抗 (LEIS) 是通過向被測電極施加一個微擾電壓,可以精確測量局部區域固/液界面的阻抗行為[56],從而分析局部腐蝕速率和生物膜下的差異。此外,掃描電化學顯微鏡 (SECM),掃描振動電極 (SVET)、掃描Kelvin探針 (SKP) 等微區電化學技術也得到相應的發展和應用。
4.1.3 腐蝕產物表征
金屬表面的腐蝕產物形貌及成分分析對研究IRB影響下的腐蝕機制是不可或缺的。目前最常用的微觀形貌表征手段有掃描電子顯微鏡 (SEM)、透射電子顯微鏡 (TEM),與其聯用能譜 (EDS) 可進行元素分析。而腐蝕產物的物相分析常采用X射線衍射 (XRD)、X射線光電子能譜 (XPS)、Raman光譜分析等,多種方法相互驗證,為確定產物成分提供可靠論證。
4.2 生物學研究方法
研究IRB對金屬腐蝕的影響時,IRB的種類及其代謝特點、附著生物膜特征等信息必不可少,現代生物技術的發展為此提供了有力的工具。
4.2.1 IRB的分類
微生物的分類方法包括單菌株測序、宏基因高通量測序等。應用基因序列分析可鑒定生物之間的親緣性,確定細菌分類及代謝特點,分析群落結構豐富度和多樣性。其中,16SrRNA基因測序可以對特定環境下細菌和古菌的IRB種類和豐度進行有效的鑒定;而聚合酶鏈式反應技術 (PCR) 在短時間內大量擴增特定的DNA片段,用于序列分析、基因表達調控等。
4.2.2 生物膜表征
被微生物附著的樣品經過超臨界脫水后可以保留完整的微生物和胞外多聚物 (EPS) 形貌,在SEM下可以觀察到其在金屬表面的附著狀態,但SEM無法給出細菌的存活狀態和生物膜厚度。激光掃描共聚焦顯微鏡 (CLSM) 可以有效解決這一問題。觀察前用不同的染料對含生物膜樣品進行染色,生物膜中不同的成分與特定的染料結合,在CLSM下會激發出不同的熒光,確定生物膜中不同組分的分布情況。例如,用Live/Dead染料染色后的細菌,活細胞顯示為綠色,而死細胞顯示為紅色,同時可以進行3D圖像采集,既可以獲得細菌在金屬表面的存活狀態,也可以獲得直觀的生物膜厚度。
4.2.3 基因敲除
分子生物學技術的發展使得基因敲除技術得到越來越廣泛的應用,根據生物種類的不同,主要用到RecA系統同源重組法、CRISPR/Cas系統介導的基因敲除法和基于自殺載體的同源重組法等[57]。在IRB電子傳遞方式的研究過程中,通過敲除與電子傳遞相關的酶基因,可以進一步確定IRB的電子傳遞機制,Geobacter作為模式菌種已有所研究。例如,Summers等[58]利用基因敲除手段去除Geobacter sulfurreducens菌株中的色素蛋白Omcs (一種調節c型細胞色素的蛋白) 基因,再與Geobacter metallireducens構建共培養體系后證明了Geobacter sulfurreducens的導電纖毛參與種間直接電子傳遞的機制。Liu等[59]敲除Geobacter sulfurreducens菌株的Omcs基因后認為,納米磁鐵礦會促進Geobacter sulfurreducens和Geobacter metallireducens的直接電子傳遞過程。但是,由于IRB種類的復雜性和技術的局限,大部分IRB菌株還未見應用。在MIC研究領域,利用基因敲除技術去除與微生物腐蝕活性表達有關的基因,有助于明確微生物對金屬腐蝕產生影響的直接因素,目前已應用在SRB、銅綠假單胞菌等所致金屬腐蝕的研究中。例如,Huang等[60]通過基因敲除證實了銅綠假單胞菌中的phzM和phzS基因片段調控X80碳鋼的EET-MIC。但是在IRB所致金屬腐蝕的機制研究中,基因敲除的應用還比較少,具有較大的應用前景。
5 結語
綜上所述,IRB作為一類重要的鐵代謝菌,研究其對海水環境中金屬的腐蝕影響意義重大。結合研究現狀,針對存在的問題提出幾點建議:第一,體系中參數的控制 (如溶解氧) 對研究IRB的腐蝕作用非常關鍵,尤其是有氧環境下應盡量減少溶解氧變化產生的影響,可以采用通氧或通空氣的方式使體系內溶解氧保持濃度;第二,對生物膜內部微環境檢測手段的提升和改善對研究IRB腐蝕影響機理具有重要意義;第三,IRB對O2的消耗容易造成貧氧環境,在實際海洋環境中能夠為厭氧菌提供有利的生存環境,IRB與其他微生物混合作用所致腐蝕的機理需要進一步研究。
參考文獻
[1] Mansfeld F. The interaction of bacteria and metal surfaces [J]. Electrochim. Acta, 2007, 52: 7670
[2] Shi X B, Yang C G, Yan W, et al. Microbiologically influenced corrosion of pipeline steels [J]. J. Chin. Soc. Corros. Prot., 2019, 39: 9
[2] (史顯波, 楊春光, 嚴偉等. 管線鋼的微生物腐蝕 [J]. 中國腐蝕與防護學報, 2019, 39: 9)
[3] Zhang P Y, Xu D K, Li Y C, et al. Electron mediators accelerate the microbiologically influenced corrosion of 304 stainless steel by the Desulfovibriovulgaris biofilm [J]. Bioelectrochemistry, 2015, 101: 14
doi: 10.1016/j.bioelechem.2014.06.010 pmid: 25023048
[4] Yi Y, Cho P, Al Zaabi A, et al. Potentiodynamic polarization behaviour of AISI type 316 stainless steel in NaCl solution [J]. Corros. Sci., 2013, 74: 92
[5] Zuo R J. Biofilms: Strategies for metal corrosion inhibition employing microorganisms [J]. Appl. Microbiol. Biotechnol., 2007, 76: 1245
doi: 10.1007/s00253-007-1130-6 pmid: 17701408
[6] Jia R, Unsal T, Xu D K, et al. Microbiologically influenced corrosion and current mitigation strategies: A state of the art review [J]. Int. Biodeterior. Biodegrad., 2019, 137: 42
[7] Jia R, Yang D Q, Xu D K, et al. Electron transfer mediators accelerated the microbiologically influence corrosion against carbon steel by nitrate reducing Pseudomonas aeruginosa biofilm [J]. Bioelectrochemistry, 2017, 118: 38
doi: 10.1016/j.bioelechem.2017.06.013 pmid: 28715664
[8] Vargas M, Kashefi K, Blunt-Harris E L, et al. Microbiological evidence for Fe(III) reduction on early Earth [J]. Nature, 1998, 395: 65
doi: 10.1038/25720 pmid: 9738498
[9] Guan F, Zhai X F, Duan J Z, et al. Progress on influence of cathodic polarization on sulfate-reducing bacteria induced corrosion [J]. J. Chin. Soc. Corros. Prot., 2018, 38: 1
[9] (管方, 翟曉凡, 段繼周等. 陰極極化對硫酸鹽還原菌腐蝕影響的研究進展 [J]. 中國腐蝕與防護學報, 2018, 38: 1)
doi: 10.11902/1005.4537.2016.216
[10] Javaherdashti R. Microbiologically Influenced Corrosion-An Engineering Insight [M]. Switzerland: Springer International Publishing, 2017
[11] Rousseau R, Santaella C, Bonnafous A, et al. Halotolerant bioanodes: The applied potential modulates the electrochemical characteristics, the biofilm structure and the ratio of the two dominant genera [J]. Bioelectrochemistry, 2016, 112: 24
doi: 10.1016/j.bioelechem.2016.06.006 pmid: 27429069
[12] Liu W Z, Wang A J, Sun D, et al. Characterization of microbial communities during anode biofilm reformation in a two-chambered microbial electrolysis cell (MEC) [J]. J. Biotechnol., 2012, 157: 628
doi: 10.1016/j.jbiotec.2011.09.010 pmid: 21939699
[13] Li J L, Wang T, Yu S X, et al. Community characteristics and ecological roles of bacterial biofilms associated with various algal settlements on coastal reefs [J]. J. Environ. Manage., 2019, 250: 109459
[14] Bayat Z, Hassanshahian M, Hesni M A. Enrichment and isolation of crude oil degrading bacteria from some mussels collected from the Persian Gulf [J]. Mar. Pollut. Bull., 2015, 101: 85
[15] You Y S, Zheng S L, Zang H M, et al. Stimulatory effect of magnetite on the syntrophic metabolism of Geobacter co-cultures: Influences of surface coating [J]. Geochim. Cosmochim. Acta, 2019, 256: 82
[16] Zhao Z Q, Sun C, Li Y, et al. Upgrading current method of anaerobic co-digestion of waste activated sludge for high-efficiency methanogenesis: Establishing direct interspecies electron transfer via ethanol-type fermentation [J]. Renew. Energ., 2020, 148: 523
[17] Táncsics A, Farkas M, Szoboszlay S, et al. One-year monitoring of meta-cleavage dioxygenase gene expression and microbial community dynamics reveals the relevance of subfamily I.2.C extradiol dioxygenases in hypoxic, BTEX-contaminated groundwater [J]. Syst. Appl. Microbiol., 2013, 36: 339
doi: 10.1016/j.syapm.2013.03.008 pmid: 23706914
[18] Nair H P, Puthusseri R M, Vincent H, et al. 16S rDNA-based bacterial diversity analysis of Arabian Sea sediments: A metagenomic approach [J]. Ecolog. Genet. Genomic., 2017, 3: 47
[19] Gittel A, Kofoed M V W, S?rensen K B, et al. Succession of Deferribacteres and Epsilonproteobacteria through a nitrate-treated high-temperature oil production facility [J]. Syst. Appl. Microbiol, 2012, 35: 165
doi: 10.1016/j.syapm.2012.01.003 pmid: 22381470
[20] Slobodkin A, Campbell B, Cary S C, et al. Evidence for the presence of thermophilic Fe(III)-reducing microorganisms in deep-sea hydrothermal vents at 13°N (East Pacific Rise) [J]. FEMS Microbiol. Ecol., 2001, 36: 235
doi: 10.1111/j.1574-6941.2001.tb00844.x pmid: 11451528
[21] Slobodkina G B, Kolganova T V, Chernyh N A, et al. Deferribacter autotrophicus sp. nov., an iron (III)-reducing bacterium from a deep-sea hydrothermal vent [J]. Int. J. Syst. Evol. Microbiol., 2009, 59: 1508
doi: 10.1099/ijs.0.006767-0 pmid: 19502344
[22] Lin T J, Breves E A, Dyar M D, et al. Magnetite formation from ferrihydrite by hyperthermophilic archaea from Endeavour Segment, Juan de Fuca Ridge hydrothermal vent chimneys [J]. Geobiology, 2014, 12: 200
doi: 10.1111/gbi.12083 pmid: 24612368
[23] Slobodkina G B, Kolganova T V, Querellou J, et al. Geoglobus acetivorans sp. nov., an iron (III)-reducing archaeon from a deep-sea hydrothermal vent [J]. Int. J. Syst. Evol. Microbiol., 2009, 59: 2880
doi: 10.1099/ijs.0.011080-0 pmid: 19628601
[24] He J Z, Qu D, Zhang L L. DissImilatory Fe(III) reduction by microorganisms [J]. Microbiol. Chin., 2006, 33(5): 158
[24] (賀江舟, 曲東, 張莉利. Fe(III) 的微生物異化還原 [J]. 微生物學通報, 2006, 33(5): 158)
[25] Smith J A, Aklujkar M, Risso C, et al. Mechanisms involved in Fe(III) respiration by the hyperthermophilic archaeon Ferroglobus placidus [J]. Appl. Environ. Microbiol., 2015, 81: 2735
[26] Herrera L K, Videla H A. Role of iron-reducing bacteria in corrosion and protection of carbon steel [J]. Int. Biodeterior. Biodegrad., 2009, 63: 891
[27] Niu Y, Lin Z L, Lin G J, et al. Research on corrosion behavior of Q235 steel in marine iron-oxidizing bacteria [J]. Marin. Environ. Sci., 2014, 33: 739
[27] (牛艷, 林振龍, 林國基等. Q235鋼在海洋鐵細菌作用下的腐蝕行為研究 [J]. 海洋環境科學, 2014, 33: 739)
[28] Chen R, Liu H, Tong M, et al. Impact of Fe(II) oxidation in the presence of iron-reducing bacteria on subsequent Fe(III) bio-reduction [J]. Sci. Total Environ., 2018, 639: 1007
[29] Vecchia E D, Suvorova E I, Maillard J, et al. Fe(III) reduction during pyruvate fermentation by Desulfotomaculum reducens strain MI-1 [J]. Geobiology, 2014, 12: 48
pmid: 24279507
[30] Lehours A C, Rabiet M, Morel-Desrosiers N, et al. Ferric iron reduction by fermentative strain BS2 isolated from an iron-rich anoxic environment (Lake Pavin, France) [J]. Geomicrobiol. J., 2010, 27: 714
[31] Weber K A, Achenbach L A, Coates J D. Microorganisms pumping iron: Anaerobic microbial iron oxidation and reduction [J]. Nat. Rev. Microbiol., 2006, 4: 752
doi: 10.1038/nrmicro1490 pmid: 16980937
[32] Nevin K P, Lovley D R. Lack of production of electron-shuttling compounds or solubilization of Fe(III) during reduction of insoluble Fe(III) oxide by Geobacter metallireducens [J]. Appl. Environ. Microbiol., 2000, 66: 2248
doi: 10.1128/aem.66.5.2248-2251.2000 pmid: 10788411
[33] Burns J L, Ginn B R, Bates D J, et al. Outer membrane-associated serine protease involved in adhesion of Shewanella oneidensis to Fe(Ⅲ) oxides [J]. Environ. Sci. Technol., 2010, 44: 68
[34] Marsili E, Baron D B, Shikhare I D, et al. Shewanella secretes flavins that mediate extracellular electron transfer [J]. Proc. Natl. Acad. Sci. USA, 2008, 105: 3968
doi: 10.1073/pnas.0710525105 pmid: 18316736
[35] Gu T Y, Jia R, Unsal T, et al. Toward a better understanding of microbiologically influenced corrosion caused by sulfate reducing bacteria [J]. J. Mater. Sci. Technol., 2019, 35: 631
[36] Little B, Ray R. A perspective on corrosion inhibition by biofilms [J]. Corrosion, 2002, 58: 424
[37] Videla H A, Herrera L K. Understanding microbial inhibition of corrosion. A comprehensive overview [J]. Int. Biodeterior. Biodegrad., 2009, 63: 896
[38] Obuekwe C O, Westlake D W S, Plambeck J A, et al. Corrosion of mild steel in cultures of ferric iron reducing bacterium isolated from crude oil i. polarization characteristics [J]. Corrosion, 1981, 37: 461
[39] Little B, Wagner P, Hart K, et al. The role of biomineralization in microbiologically influenced corrosion [J]. Biodegradation, 1998, 9: 1
doi: 10.1023/a:1008264313065 pmid: 9807800
[40] Chen S Q, Zhang D. Corrosion behavior of Q235 carbon steel in air-saturated seawater containing Thalassospira sp. [J]. Corros. Sci., 2019, 148: 71
[41] Moreira R, Schutz M K, Libert M, et al. Influence of hydrogen-oxidizing bacteria on the corrosion of low carbon steel: Local electrochemical investigations [J]. Bioelectrochemistry, 2014, 97: 69
doi: 10.1016/j.bioelechem.2013.10.003 pmid: 24177135
[42] Esnault L, Jullien M, Mustin C, et al. Metallic corrosion processes reactivation sustained by iron-reducing bacteria: Implication on long-term stability of protective layers [J]. Phys. Chem. Earth, 2011, 36: 1624
[43] Dubiel M, Hsu C H, Chien C C, et al. Microbial iron respiration can protect steel from corrosion [J]. Appl. Environ. Microbiol., 2002, 68: 1440
pmid: 11872499
[44] Cote C, Rosas O, Basseguy R. Geobacter sulfurreducens: An iron reducing bacterium that can protect carbon steel against corrosion? [J]. Corros. Sci., 2015, 94: 104
doi: 10.1016/j.corsci.2015.01.044
[45] Volkland H P, Harms H, Kaufmann K, et al. Repair of damaged vivianite coatings on mild steel using bacteria [J]. Corros. Sci., 2001, 43: 2135
doi: 10.1016/S0010-938X(01)00004-X
[46] Sun H F, Shi B Y, Lytle D A, et al. Formation and release behavior of iron corrosion products under the influence of bacterial communities in a simulated water distribution system [J]. Environ. Sci.-Process Impacts, 2014, 16: 576
doi: 10.1039/c3em00544e pmid: 24509822
[47] Wang H B, Hu C, Hu X X, et al. Effects of disinfectant and biofilm on the corrosion of cast iron pipes in a reclaimed water distribution system [J]. Water Res., 2012, 46: 1070
doi: 10.1016/j.watres.2011.12.001
[48] Yan B Z, Wrenn B A, Basak S, et al. Microbial reduction of Fe(III) in hematite nanoparticles by Geobacter sulfurreducens [J]. Environ. Sci. Technol., 2008, 42: 6526
doi: 10.1021/es800620f pmid: 18800525
[49] Liu H W, Gu T Y, Asif M, et al. The corrosion behavior and mechanism of carbon steel induced by extracellular polymeric substances of iron-oxidizing bacteria [J]. Corros. Sci., 2017, 114: 102
doi: 10.1016/j.corsci.2016.10.025
[50] Wang H B, Hu C, Zhang L L, et al. Effects of microbial redox cycling of iron on cast iron pipe corrosion in drinking water distribution systems [J]. Water Res., 2014, 65: 362
doi: 10.1016/j.watres.2014.07.042
[51] Li X X, Wang H B, Hu X X, et al. Characteristics of corrosion sales and biofilm in aged pipe distribution systems with switching water source [J]. Eng. Fail. Anal., 2016, 60: 166
[52] Wang H B, Hu C, Li X X. Characterization of biofilm bacterial communities and cast iron corrosion in bench-scale reactors with chloraminated drinking water [J]. Eng. Fail. Anal., 2015, 57: 423
[53] Lee J S, McBeth J M, Ray R I, et al. Iron cycling at corroding carbon steel surfaces [J]. Biofouling, 2013, 29: 1243
doi: 10.1080/08927014.2013.836184 pmid: 24093730
[54] Chen S Q, Deng H, Liu G Z, et al. Corrosion of Q235 carbon steel in seawater containing mariprofundus ferrooxydans and Thalassospira sp. [J]. Front. Microbiol., 2019, 10: 936
doi: 10.3389/fmicb.2019.00936 pmid: 31134004
[55] Black E, Owens K, Staub R, et al. Evaluation of AISI Type 304 stainless steel as a suitable surface material for evaluating the efficacy of peracetic acid-based disinfectants against Clostridium difficile spores [J]. PLoS One, 2017, 12: e0187074
[56] Mouanga M, Puiggali M, Tribollet B, et al. Galvanic corrosion between zinc and carbon steel investigated by local electrochemical impedance spectroscopy [J]. Electrochim. Acta, 2013, 88: 6
[57] Wang X, Huang J Z, Li L. Advances in gene knockout techniques in microbiology [J]. J. Microbiol., 2019, 39(4): 100
[57] (王雪, 黃健中, 李力. 基因敲除技術在微生物中的應用 [J]. 微生物學雜志, 2019, 39(4): 100)
[58] Summers Z M, Fogarty H E, Leang C, et al. Direct exchange of electrons within aggregates of an evolved syntrophic coculture of anaerobic bacteria [J]. Science, 2010, 330: 1413
doi: 10.1126/science.1196526 pmid: 21127257
[59] Liu F H, Rotaru A E, Shrestha P M, et al. Magnetite compensates for the lack of a pilin-associated c-type cytochrome in extracellular electron exchange [J]. Environ. Microbiol., 2015, 17: 648
doi: 10.1111/1462-2920.12485 pmid: 24725505
[60] Huang L Y, Huang Y, Lou Y T, et al. Pyocyanin-modifying genes phzM and phzS regulated the extracellular electron transfer in microbiologically-influenced corrosion of X80 carbon steel by Pseudomonas aeruginosa [J]. Corros. Sci., 2019, 164: 108355
免責聲明:本網站所轉載的文字、圖片與視頻資料版權歸原創作者所有,如果涉及侵權,請第一時間聯系本網刪除。

官方微信
《中國腐蝕與防護網電子期刊》征訂啟事
- 投稿聯系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 中國腐蝕與防護網官方QQ群:140808414





