核能是一種清潔能源,核能發電排放的溫室氣體量僅為傳統化石燃料的1/50[1]。近幾十年來我國核能行業迅速發展,核電廠在滿足全國供電需求的同時,也將產生大量的核廢料,據估算,截止到2020年,這些核廢料總量約83000 t HM[2],因此,需要將這些核廢料妥善處置。其中,高放射性廢物(HLW)由于放射性水平高、半衰期長、熱量大、毒性大等[3~5]特點需要進行永久處置以避免危害人類生活。目前各國認可的處置高放廢物的方式為深地質處置。2006年,我國發布了首個高放廢物地質處置的政府文件《高放廢物地質處置研究開發規劃指南》,并計劃在2050年建成中國高放廢物處置庫(DGR)[6]。經過多年考察,我國已經選擇甘肅北山地區為建造深地質處置庫的預選場址[7]。
在DGR中會經歷從初期的有氧、高溫環境到后期氧含量降低至接近為零,溫度逐漸下降20℃左右的漫長演變過程[4],核廢料的放射性降低到原來鈾礦的放射水平也需要近萬年時間[8~10]。因此金屬儲罐作為使核廢料與外界環境完全隔離的屏障之一,其設計使用壽命需要達到萬年以上[11]。在金屬儲罐的候選材料中,Cu和碳鋼被研究的最多。碳鋼因其硬度大、塑性好、腐蝕行為可預測、價格低廉等優點被許多國家選為候選材料,如法國、瑞士、日本和比利時等國家;Cu因為有良好的耐蝕性,且相比其他耐蝕性金屬,Cu在含有Cl-的溶液中通常發生均勻腐蝕,被加拿大、芬蘭、瑞典等國家選用候選材料[12]。目前,我國暫未確定金屬儲罐的制作材料,近幾年對低碳鋼在深地質環境中的腐蝕行為研究較多[13~16],但碳鋼的缺點是耐蝕性較差。加拿大曾提出在碳鋼表面鍍一層銅鍍層以提高金屬儲罐的耐蝕性[17],鍍銅鋼儲罐結合了碳鋼和銅的優點,可以作為金屬儲罐的候選材料之一。但是當銅鍍層表面出現缺陷時,內部碳鋼暴露,銅和碳鋼在地下水溶液中存在發生電偶腐蝕的風險,加快金屬儲罐的腐蝕失效速度。因此,若選擇鍍銅鋼作為我國金屬儲罐材料,需充分考慮銅和碳鋼在北山地下水環境中的電偶腐蝕。
我國北山地區地下水中主要的侵蝕性離子為
1 實驗方法
實驗所用金屬材料為T2銅合金和Q235鋼,均購自山東晟鑫科技有限公司。T2銅合金的化學成分(質量分數,%)為:Zn 0.005,Pb 0.005,Sn 0.002,Ni 0.005,Fe 0.005,Sb 0.002,S 0.005,As 0.002和Cu余量,Q235鋼的化學成分(質量分數,%)為:C 0.181,Si 0.208,P 0.041,S 0.035,Al 0.266,Mn 0.552,Cu 0.167和Fe余量。采用線切割的方式將兩種金屬材料加工成高度為5 mm,直徑不同的圓柱形金屬試樣,其中T2銅合金的直徑分別為25.3和56.6 mm,Q235鋼的直徑為4和8 mm,通過組合不同面積的銅合金和碳鋼,形成不同面積比的電偶對。選擇試樣的任一圓形面為工作面,相對的另一面焊接銅導線后,用環氧樹脂密封,制成電極。工作面分別用400#,600#,800#,1000#,1500#以及3000#的SiC砂紙逐級濕磨,打磨好后用無水乙醇超聲清洗10 min后用N2吹干,放入玻璃干燥器中備用。實驗中所有溶液均采用分析純試劑和電阻率為18.2 MΩ·cm的超純水配制。北山地下水中主要陽離子為Ca2+、Na+、K+和Mg2+,陰離子為Cl-、
使用CHI 604E電化學工作站分別測試T2銅合金和Q235鋼的開路電位(OCP),在三電極體系,其中參比電極為飽和Ag/AgCl電極(0.198 V vs. SHE),對電極為1 cm × 1 cm的Pt電極,測試時間持續1 h。極化曲線和電偶腐蝕實驗使用內置有零電阻電流計(ZRA)的Ivium-n-Stat多通道電化學工作站進行測試。進行極化曲線測試時掃描速率為10 mV·min-1,掃描范圍為OCP ± 300 mV。電偶腐蝕實驗中,Q235鋼為工作電極,T2銅合金為對電極,參比電極為飽和Ag/AgCl電極,實驗中始終保持工作電極和對電極的距離約為1 cm。組裝好的電解池固定好后放入恒溫箱中保持溫度為25或50℃,實驗開始前,用氣泵向溶液中通空氣3 h以保持有氧狀態,并持續通氣至測試結束,待電偶電流和電偶電壓穩定后,記錄最后10 h數據取平均值。實驗結束后,將需要進行表面分析的Q235鋼電極小心取出,用超純水清洗表面(不破壞腐蝕產物),無水乙醇脫水、N2吹干后暫放于手套箱中。
使用Regulus 8100場發射掃描電子顯微鏡(SEM)對Q235鋼表面進行腐蝕產物形貌表征,LabRAM HR Evolution拉曼光譜儀(Raman,激發波長633 nm,掃描范圍為100~2000 cm-1)進行腐蝕產物組成分析,DDS-11A電導率儀對溶液的電導率進行測試。
2 結果與討論
2.1 OCP測試
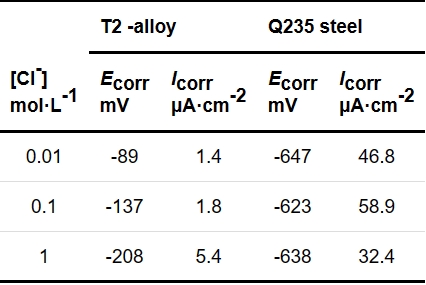
圖1
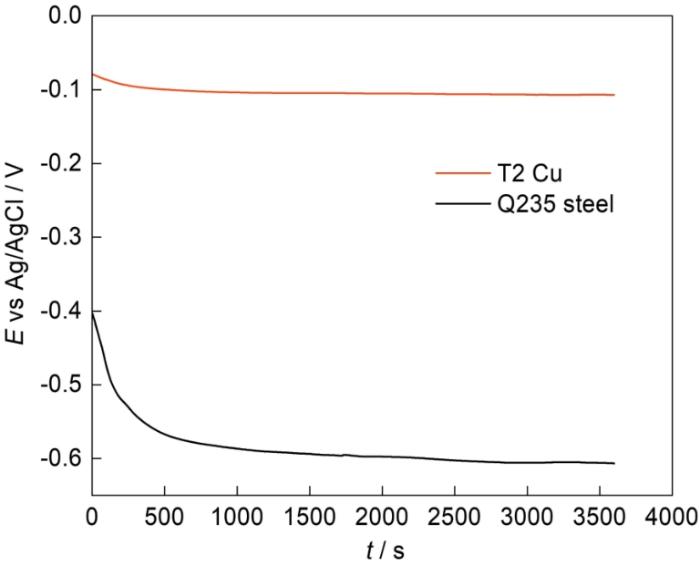
圖1 T2銅合金和Q235鋼在北山地下水模擬液中的OCP-t曲線
Fig.1 OCP-t curves of T2 Cu-based alloy and Q235 steel in simplified Beishan groundwater simulation fluid
25℃時Cl-濃度變化對T2銅合金和Q235鋼OCP的影響如圖2所示。Cl-濃度從0.001 mol·L-1增大到2 mol·L-1,T2銅合金的OCP整體出現明顯的負移,負移值為230 mV;Q235鋼的OCP先負移,后在0.05 mol·L-1到0.1 mol·L-1之間出現波動,最后在2 mol·L-1時又正移到-0.56 V,與在0.001 mol·L-1時數值幾乎相同。可以看出,隨著Cl-濃度增大,在一定濃度范圍內,T2銅合金和Q235鋼的OCP均出現了明顯的負移,表明Cl-濃度從0.001 mol L-1增大到0.05 mol·L-1時,銅合金和碳鋼的腐蝕傾向均增加。當Cl-濃度繼續增大時,T2銅合金的OCP在0.05 mol·L-1后出現小幅正移后又繼續大幅負移,表明T2銅合金在Cl-濃度較大時腐蝕傾向也在增加;而Q235鋼的OCP在0.1 mol·L-1到1 mol·L-1出現小幅度負移,在1 mol·L-1之后出現明顯的正移,表明Q235鋼的腐蝕傾向在1 mol·L-1之后減小。T2銅合金和Q235鋼OCP之間的差值在Cl-濃度大于0.1 mol·L-1時逐漸減小,表明它們之間的耦合效應可能在Cl-濃度較大時逐漸減弱。
圖2
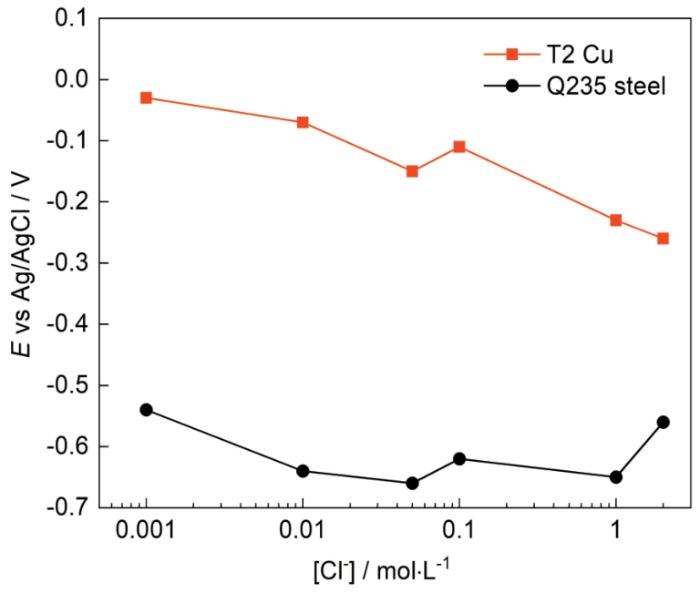
圖2 25℃時Cl-濃度對T2銅合金和Q235鋼OCP的影響
Fig.2 Influences of Cl- concentration on OCP values of T2 Cu-based alloy and Q235 steel at 25oC
2.2 極化曲線測試
為進一步探究Cl-濃度變化對T2銅合金和Q235鋼腐蝕行為的影響,分別在0.01、0.1、1 mol·L-1溶液中對T2銅合金和Q235鋼進行極化曲線測試,測試結果如圖3所示,表1為極化曲線擬合結果。如圖3a所示,T2銅合金的陰極極化受氧擴散控制,陽極極化表現為金屬的活性溶解;在Cl-濃度為0.01和1 mol·L-1時,T2銅合金的陽極極化分支出現鈍化現象,是由于在Cl-濃度較大時,銅合金表面形成了比較致密的鈍化膜,使得電流密度出現了短暫的下降;隨后鈍化膜被擊穿,電流密度繼續升高。T2銅合金的腐蝕電位Ecorr隨Cl-濃度增大出現負移,與OCP的結果相對應;腐蝕電流密度Icorr隨Cl-濃度增大而增大,表明Cl-濃度增大會使T2銅合金的腐蝕速率加快。在圖3b中,Q235鋼的陰極極化明顯也受氧擴散控制,陽極極化均表現為金屬的活性溶解,沒有出現鈍化現象。Ecorr先正移后有所負移,Icorr先增大后減小,表明隨Cl-濃度增大,Q235鋼的腐蝕速率先增大后減小,過高的Cl-濃度會抑制Q235鋼的腐蝕。從表1數據可以看出,在相同的溶液中,T2銅合金的腐蝕速率會明顯低于Q235鋼。因此對于“鍍銅鋼”金屬儲罐,在銅鍍層未發生破損前,具有比碳鋼更好的耐蝕性,可以有效延長金屬儲罐的使用壽命。
圖3
圖3 T2銅合金和Q235鋼在25℃含不同Cl-濃度的溶液中的極化曲線
Fig.3 Polarization curves of T2 Cu-based alloy (a) and Q235 steel (b) in test solutions with different Cl- concentrations at 25oC
表1 T2銅合金和Q235鋼的極化曲線擬合參數
Table 1
2.3 電偶腐蝕實驗
一旦銅鍍層發生破損并裸漏出碳鋼基體,可能會導致碳鋼基體發生嚴重的腐蝕。在鍍銅鋼材料中,銅鍍層直接與鋼基體接觸,無法直接測試電偶電壓和電偶電流[20],且在實驗中如果銅鍍層出現進一步破損,則電偶對的面積比將發生變化,影響實驗結果的準確性。因此,本研究中將金屬材料T2銅合金和Q235鋼分別做成電極進行實驗,且實驗中始終保持銅電極和碳鋼電極之間的距離為1 cm。不同Cl-濃度下T2銅合金和Q235鋼耦合后碳鋼表面的電偶電流密度(Ig,電偶電流與碳鋼表面積的比值)和耦合后的電偶電壓(Eg)如圖4和圖5所示。除了Cl-濃度外,還研究了溫度和銅合金/碳鋼面積比對電偶腐蝕的影響。實驗在數據穩定至少10 h后停止測試,每個實驗時間為2~5 d。如圖4a,電偶對面積比為200∶1時的Ig明顯大于電偶對面積比為10∶1時的Ig,說明電偶腐蝕速率與銅合金的面積有關,受陰極反應控制。在T2銅合金和Q235鋼組成的電偶對中,T2銅合金表面主要發生O2的還原反應,Q235鋼作為陽極主要發生Fe的氧化。因此,在電偶腐蝕中,O2在銅合金表面的還原反應為速度控制步驟。面積比增大時,更多O2可以在銅合金表面還原,陰極電流增加,在電偶腐蝕中陰極陽極電流保持相等,所以當陽極面積相對較小時,Ig增大。
圖4
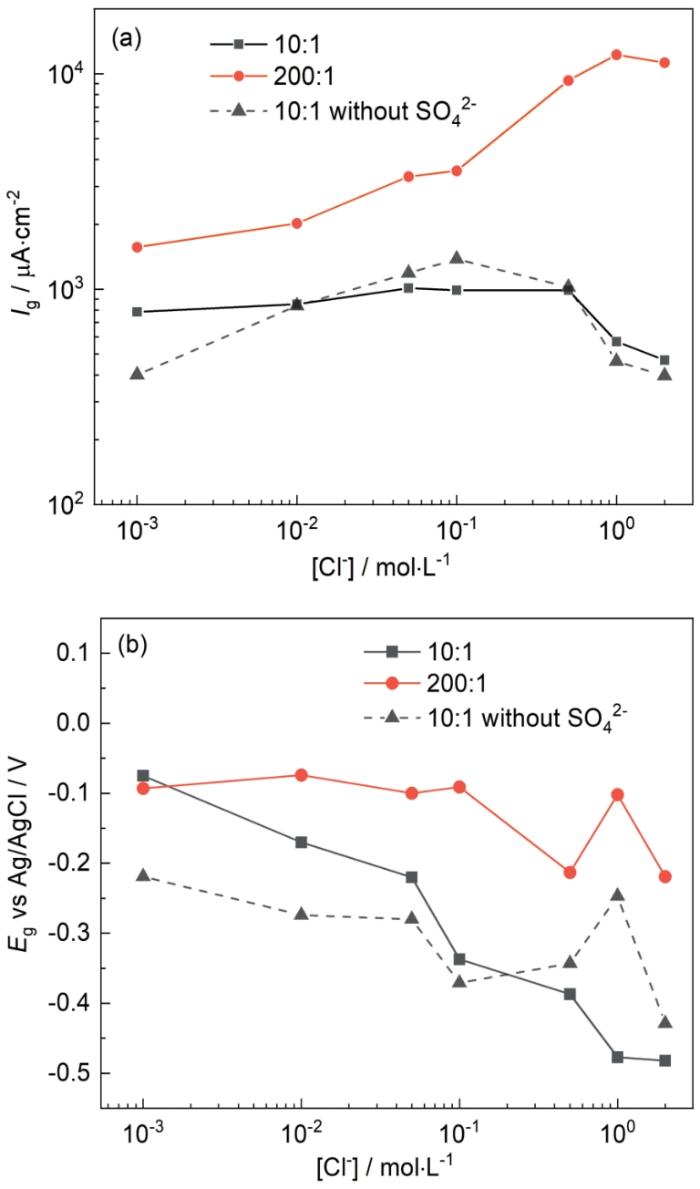
圖4 25℃時Cl-濃度對碳鋼表面電偶電流密度和電偶電壓的影響
Fig.4 Influences of Cl- concentration on galvanic current density (a) and galvanic potential (b) of Q235 steel at 25oC
圖5
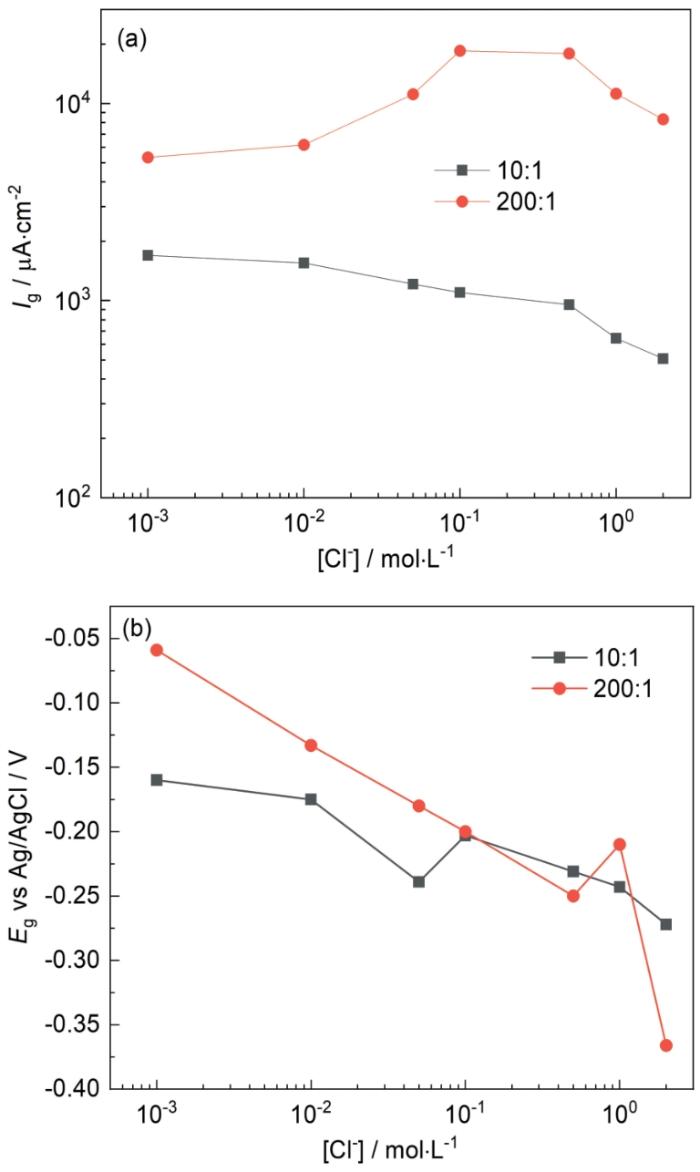
圖5 50℃時Cl-濃度對碳鋼表面的電偶電流密度和電偶電壓的影響
Fig.5 Influences of Cl- concentration on galvanic current density (a) and galvanic potential (b) of Q235 steel at 50oC
在溶液中隨著Cl-濃度增大,溶液中O2的溶解度降低。有文獻指出在22℃時,O2在0.1 mol·L-1 NaCl溶液中的溶解度為在3 mol·L-1 NaCl溶液中的2.7倍[23];在25℃時,O2在1 mol·L-1 NaCl溶液中的溶解度為在2 mol·L-1 NaCl溶液中的1.4倍,且O2溶解度降低的速率隨Cl-濃度增大變緩[24],溶解O2的降低會導致溶液中的氧濃度梯度下降,減少O2到銅合金表面的擴散通量,影響O2在銅合金表面的還原速率,進而降低電偶腐蝕速率。有文獻也指出NaCl溶液中隨Cl-濃度增大,O2的擴散系數會減小[25],進而降低O2到銅合金表面的擴散通量。其次,Cl-濃度變化還會影響溶液的電導率,如圖6所示,在25℃,溶液中含有0.015 mol·L-1 Na2SO4,Cl-濃度為0.01、0.1和1 mol·L-1時,溶液電導率分別為2540、6900、42600 μS·cm-1,溶液電導率隨Cl-濃度增大而增加,電導率的增加使溶液電阻下降,同時也加速了金屬表面鈍化膜的破裂,加快陽極溶解過程,導致電偶腐蝕速率加快。因此,在溶解氧和溶液電導率的相互影響下,Ig不會隨著Cl-濃度的增大持續增大,而是存在最大值。Eg的負移可能與溶液中溶解氧的減少有關,且Eg值更靠近T2銅合金的Ecorr,這也表明了在電偶腐蝕中反應受陰極的控制。
圖6
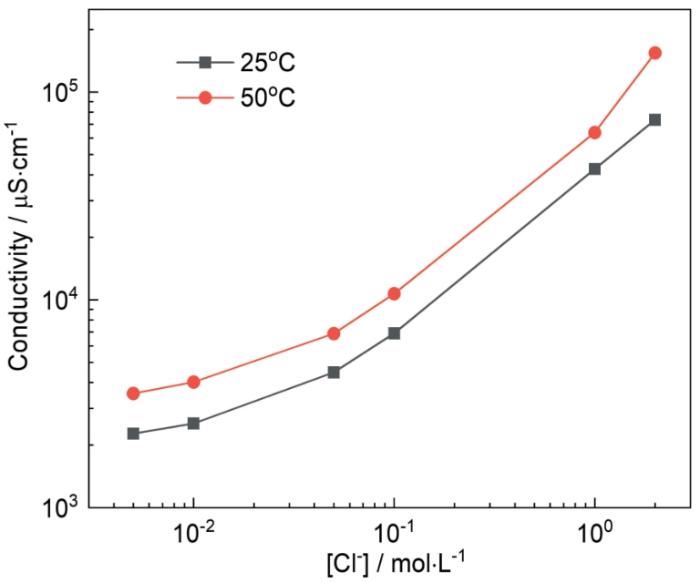
圖6 不同溫度下實驗溶液電導率隨Cl-濃度的變化
Fig.6 Variations of electrical conductivity of the test solution with Cl- concentration at 25oC and 50oC
Standish等[20]研究表明,當銅合金和碳鋼的面積比為10∶1時,Ig 在Cl-濃度為0.01~0.1 mol·L-1時出現最大值,這與本文的結果基本對應。但是當溶液中加入0.015 mol·L-1 Na2SO4,電偶對面積為10∶1時,Ig 隨Cl-濃度增大變化不明顯,這表明
50℃時Cl-濃度對Ig的影響如圖5a所示。面積比為10∶1時,Ig的數值均大于25℃時測得的數值,且Ig的最大值出現在Cl-濃度為0.001 mol·L-1時,隨Cl-濃度增大,Ig逐漸降低,在2 mol·L-1時兩個溫度下的Ig值僅相差39.6 μA·cm-2;面積比為200∶1時,Ig值在Cl-濃度低于0.5 mol·L-1時高于25℃時測得的數值,隨后Ig迅速減小最后在2 mol·L-1時為9309.2 μA cm-2,低于25℃時的11257.8 μA·cm-2。在圖5b中,Eg隨Cl-濃度增大負移,變化趨勢與25℃時相同。由圖5結果可以看出,溫度升高,會使Ig增大,即電偶腐蝕速率加快,這是因為溫度升高時,相同Cl-濃度下溶液電導率也隨之增大(圖6)。但溫度的升高也會引起溶液中溶解O2的減少,在常壓下,20℃時O2在純水中的溶解度約為50℃時的1.5倍,30℃時O2在1 mol·L-1 NaCl溶液中的溶解度約為60℃時的1.6倍[26],且隨著Cl-濃度增大,溶液中的溶解O2也會減少,因此在50℃時,Ig出現最大值時的Cl-濃度更低。
2.4 腐蝕產物分析
圖7為在25℃、面積比為10∶1時,Q235鋼在Cl-濃度分別為0.001、0.05和2 mol·L-1溶液中進行電偶腐蝕48 h后的SEM形貌圖。不同Cl-濃度下腐蝕形貌基本一致,腐蝕產物均勻分布在碳鋼表面,可分為內、外兩層,內層腐蝕產物較致密,外層腐蝕產物呈絮狀。其中,Cl-濃度為0.05 mol·L-1時(圖7c和d),碳鋼表面外層絮狀腐蝕產物最多,且聚集在一起;而Cl-濃度為0.001 mol·L-1(圖7a和b)和2 mol·L-1(圖7e和f)時,外層絮狀腐蝕產物減少,且沒有出現聚集。圖7中的腐蝕產物表面出現裂痕是因為在進行脫水干燥時腐蝕產物表面破裂所致。SEM形貌圖所示的表面腐蝕情況表明了在Cl-濃度為中等濃度時,腐蝕最嚴重,這與電偶腐蝕電化學測試結果相對應。
圖7
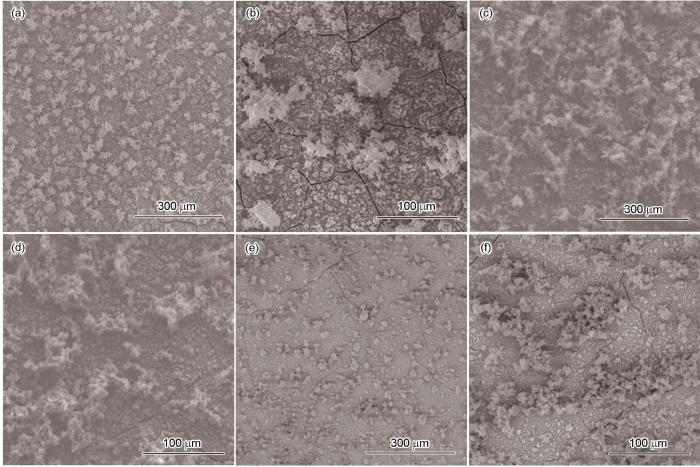
圖7 25℃時不同Cl-濃度下面積比為10∶1時Q235鋼表面腐蝕后SEM形貌圖
Fig.7 SEM surface morphologies of Q235 steel after corrosion at 25oC under the conditions of the area ratio of 10∶1 and Cl- concentrations of 0.001 mol·L-1 (a, b), 0.05 mol·L-1 (c, d), and 2 mol·L-1 (e, f)
圖8為Q235鋼在25℃下面積比為10∶1以及Cl-濃度為0.05 mol·L-1條件下溶液中電偶腐蝕48 h后的表面Raman光譜測試結果,分別對內層和外層進行測試。如圖8a和b所示,內層腐蝕產物在257 cm-1檢測到明顯的纖鐵礦γ-FeOOH[27]的特征Raman峰,在307、387 cm-1處檢測到明顯的針鐵礦α-FeOOH[28,29]的特征Raman峰,在1318 cm-1處檢測到少量α-Fe2O3[30]的特征峰;在535 cm-1處可見磁鐵礦Fe3O4[30]的特征Raman峰;在外層,如圖8c,d所示,腐蝕產物主要為α-Fe2O3[31],其特征Raman峰位于231、297、412、500、612和1324 cm-1處,此外還有α-FeOOH和少量位于670 cm-1處的Fe3O4特征Raman峰。在Raman測試的結果中并未發現Fe的氯化物的特征Raman峰,可能因為Cl-濃度較低和測試時間較短,Fe的氯化物沒有在碳鋼表面沉積,也有研究表明Cl-在溶液中可以通過促進陽極溶解來加速腐蝕,生成的FeCl2不穩定容易被氧化成FeOOH,Cl-又重新釋放回溶液中[32],在這個過程中Cl-起到某種催化劑的作用。從Raman測試結果可以看出,在電偶腐蝕中,陽極發生溶解后會先生成γ-FeOOH,由于γ-FeOOH不穩定,容易被轉化成比較穩定的α-FeOOH,當腐蝕產物暴露在空氣中時生成更穩定的α-Fe2O3;而當腐蝕產物形成后內層由于氧氣減少,FeOOH會部分轉化成Fe3O4,腐蝕產物會減緩碳鋼基體的腐蝕速率,因此在進行電偶腐蝕測試時總是觀察到Ig隨測試時間的進行逐漸變小直至穩定。
圖8
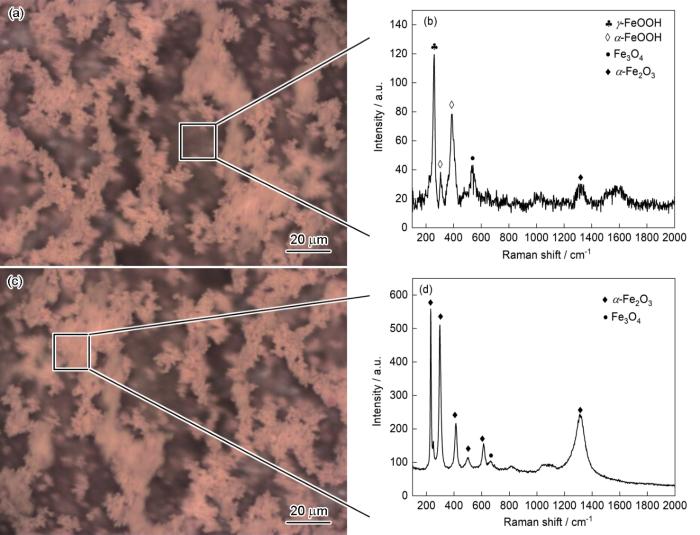
圖8 Q235鋼在25℃下面積比為10∶1以及Cl-濃度為0.05 mol·L-1條件下溶液中電偶腐蝕48 h后的表面Raman光譜
Fig.8 Raman spectra of inner layer (a, b) and out layer (c, d) of corrosion products formed on Q235 steel after galvanic corrosion, at 25oC with [Cl-] = 0.05 mol·L-1, Cu/carbon steel area ratio = 10∶1
3 結論
(1) OCP測試結果表明,在簡化版北山地下水模擬液中T2銅合金和Q235鋼接觸會發生嚴重電偶腐蝕,T2銅合金為陰極受到保護,Q235鋼為陽極腐蝕速率加速;隨Cl-濃度增大OCP差值減小,耦合效應可能減弱。
(2) 極化曲線測試結果表明,T2銅合金和Q235鋼陰極極化均受氧擴散控制,陽極極化為金屬的活性溶解,隨Cl-濃度增大T2銅合金陽極極化存在鈍化現象;T2銅合金的自腐蝕速率遠低于Q235鋼,銅鍍層良好的耐蝕性可以有效延長金屬儲罐的使用壽命。
(3) 電偶腐蝕實驗表明,T2銅合金和Q235鋼之間發生的電偶腐蝕受陰極O2的還原反應控制;隨Cl-濃度增大,溶液中溶解O2含量降低、氧擴散系數減小、電導率升高等因素使得Ig存在最大值,且溫度升高時,Ig在Cl-濃度更低時出現最大值,因此,在處置庫關閉初期的有氧高溫環境中,具有中等Cl-濃度的北山地下水模擬液對T2銅合金和Q235鋼的電偶腐蝕危害較大。
(4) 腐蝕產物分析結果表明,Q235鋼表面腐蝕產物分為較致密的內層和成絮狀的外層,主要為Fe的羥基氧化物/氧化物。
免責聲明:本網站所轉載的文字、圖片與視頻資料版權歸原創作者所有,如果涉及侵權,請第一時間聯系本網刪除。

官方微信
《腐蝕與防護網電子期刊》征訂啟事
- 投稿聯系:編輯部
- 電話:010-62316606
- 郵箱:fsfhzy666@163.com
- 腐蝕與防護網官方QQ群:140808414