由圖可見,氫過電位低的陰極相雜質,如Fe、cu,對腐蝕起促進作用,使金屬腐蝕速度增大。而過電位高的雜志,如Hg,將會使基體金屬腐蝕速度變低。
表面狀態對氫過電位也有影響,粗糙表面與光滑表面相比,前者因實際面積大,電流密度小,氫過電位就小,氫去極仃腐蝕也就越嚴重。
(4)與陰極面積有關。
陰極區面積增加,氫過電位減小,析氫反應加快,導致腐蝕速度增大。從圖2可見,由于碳鋼中碳是以Fe3C的形式分散存在的,在Fe3C上的析氫過電位較低,所以碳鋼比工業純鐵腐蝕嚴重。如果含碳量越高,則局部陰極(Fe3C)的面積就越大,陰極極化率就越小,腐蝕速度就越大。因此,碳鋼在鹽酸中的腐蝕速度隨含碳量的增加而上升。
(5)與溫度有關。
溫度升高,氫過電位減小,陽極反應和陰極反應都將加快,從而使腐蝕速度加劇。
氧去極化腐蝕
在中性和堿性溶液中,氫離子濃度較小,析氫反應電位較低。因此,一般金屬腐蝕過程的陰極反應往往不可能是析氫反應。而溶液中溶解氧的還原反應電位要比氫的電位正1.229V,所以,在這種情況下,往往是吸氧反應,氧分子將作為腐蝕的去極化劑。可見氧去極化腐蝕要比氫去極化腐蝕更為普遍。自然條件(大氣、海水、土壤)下的腐蝕,大多是屬于這一類。
氧向金屬(電極)表面的輸送
在腐蝕過程中,溶解氧不斷在金屬表面還原,大氣中的氧就不斷溶入溶液并向金屬表面輸送,其過程較為復雜。如圖4所示
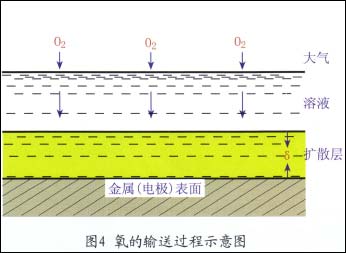
(1)氧通過空氣/溶液界面溶入溶液中。
(2)以對流和擴散方式通過溶液本體的厚度層。
(3)以控散方式通過金屬表面溶液的靜止層而達到金屬表面。
雖然擴散層厚度不大,一般為10-2~5×10-2,但氧只能以擴散這種唯一的方式通過。因此,通常擴散步驟最緩慢,導致此步成為整個陰極過程的控制步驟。
氧的還原反應及其陰極極化曲線
在酸性溶液中氧的還原反應為
02+4H++4e→2H20
在堿性溶液中氧的還原反應為
02+2H20+4e→4OH-
氧的還原反應歷程較為復雜,至今尚待研究。氧氣極化的陰極極化曲線,如圖5所示。
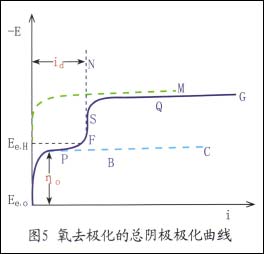
由于控制因素不同,氧還原過程的總陰極極化曲線分為四個部分:
(1)陰極過程由氧的離子化反應速度所控制
如果氧的供應充足,且在不大的電流密度下進行時,就屬于此種情況(見圖中Ee,0PBC)
在一定的電流密度范圍內,氧的過電與電流密度的對數成直線關系,并服從塔菲爾公式
η0=Ee,0一Ek=a0+b01gi
常數a0與電極材料與表面狀態有關,常數b0與電極材料無關。
但實際上,當i>1/2id時,濃度極化會出現,極化曲線的走向將偏離Ee,0PBC。
陰極過程由氧的離子化反應和氧的擴散過程混合控制
當電流為1/2id<i>id(極限擴散電流密度)時,由于濃度極化的出現,曲線將從P點開始偏離BC線而走向F點。陰極過程的速度將與氧的離子化反應和氧的擴散過程都有關。
(3)陰極過程由氧的擴散過程控制
因擴散過程的阻滯,隨電流密度增大,極化曲線開始很徒地上升,當i=id時,就形成垂直地走向FSN,電極電位大大地移向負方。此時整個陰極過程的速度完全由氧的擴散過程控制,氧去極化的過電位不再決定定于電極材料和表面狀態,而是完全取決于氧的極限擴散電流密度id,即取決于氧的溶解度及氧在溶液中的擴散條件。
免責聲明:本網站所轉載的文字、圖片與視頻資料版權歸原創作者所有,如果涉及侵權,請第一時間聯系本網刪除。
-
標簽: 腐蝕氫去極化氧去極化腐蝕

官方微信
《腐蝕與防護網電子期刊》征訂啟事
- 投稿聯系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 腐蝕與防護網官方QQ群:140808414





