王毅,張盾
山東省腐蝕科學重點實驗室,中國科學院海洋研究所,青島,中國,266071
Email:zhangdun@qdio.ac.cn
第一作者簡介
王毅(Wang Yi),男,1981年9月生,工學博士,中國科學院海洋研究所助理研究員,現從事海洋腐蝕與防護研究。2004年畢業于北京化工大學應用化學專業,獲應用化學理學學士學位。2009年在北京化工大學獲應用化學工學博士學位,之后至今在中國科學院海洋研究所海洋腐蝕與防護研究發展中心從事海洋腐蝕與防護的研究。作為課題負責人承擔國家自然科學基金青年科學基金項目和山東省自然科學基金青年項目各一項。作為研究骨干參加了863項目、中國科學院知識創新工程重要方向性項目和國家海洋局公益性項目的研究工作。攻讀博士學位期間被評為北京化工大學研究生“十大學術之星”,曾榮獲“原平化工”及“煙臺萬華”專項獎學金,并獲得化工資源有效利用國家重點實驗室優秀博士生、北京化工大學優秀研究生及北京化工大學優秀畢業生等榮譽稱號,同時博士論文被評為2010年北京市優秀博士論文。在無機功能材料組裝化學和電化學領域取得了一定研究成果,共發表各類研究論文30余篇,被SCI期刊收錄論文20篇(第一作者10篇),總影響因子加合大于60,單篇最高引用20次,申請國家發明專利11項,已授權4項,公開4項,申請國際專利2項,均已公開。

王毅
摘 要:通過動電位極化和電化學交流阻抗譜等電化學方法研究了海藻酸鈉(Sodium Alginate,SA)作為一種綠色緩蝕劑在3.5% NaCl溶液中對Q235鋼的緩蝕作用。結果表明SA對碳鋼在3.5% NaCl溶液中的緩蝕作用主要為陽極抑制型,298 K時SA在濃度為0.5 gL-1時緩蝕效率達到最高為94.7%。對熱力學參數進行了討論,表明SA在Q235鋼表面上的吸附行為服從Langmuir吸附等溫式,SA的吸附為自發的放熱過程,為典型的化學吸附。
關鍵詞:Q235鋼;緩蝕劑;海藻酸鈉;模擬海水;吸附
1 引言
在眾多防腐蝕方法中,添加緩蝕劑是一種工藝簡便、成本低廉、適應性強的緩蝕措施。但是,隨著人們環保意識的增強,以及日益嚴格的環保法規的限制,一些有毒的緩蝕劑將被限制或禁止使用[1]。因此,開發天然、低毒或無毒、環境友好型緩蝕劑已迫在眉睫[2]。近年來,人們開發了多種環境友好型緩蝕劑,范圍從無機化合物稀土元素[3-6]到有機化合物,如丁二酸[7]、氨基酸[8-10]、抗真菌藥物[11]、咖啡酸[12]、色胺[2]、巴比妥品[13, 14]和天然產物[15-17]。
海藻酸鈉(Sodium Alginate,SA)是一種提取自褐藻細胞壁的天然產物。在食品工業和日用化學品工業中被用作乳化劑或增稠劑。在制藥業中,海藻酸是常用的輔料。牙科用它來替代石膏及橡膠,制作牙模。SA是由α-L-甘露糖醛酸(M單元)與β-D-古羅糖醛酸(G單元)依靠1,4-糖苷鍵,連接并由不同GGGMMM片段組成的共聚物-甘露糖醛酸單元含有大量羧基,可與金屬配位。因此,海藻酸鈉是一類潛在的綠色緩蝕劑。但是,目前還未見相關報道。#p#分頁標題#e#
本工作采用動電位極化曲線和電化學交流阻抗(EIS)技術,對SA在模擬海水(3.5% NaCl溶液)中對Q235鋼的緩蝕性能進行了深入研究,并采用吸附等溫線研究了其緩蝕機理。
資助信息:山東省自然科學基金(ZR2010BQ017);中國科學院海洋研究所知識創新前沿項目(Y02607101Q)。
2 實驗部分
2.1 實驗試劑
分析純NaCl購自國藥集團。化學純SA(平均分子量50000)購自天津博迪化學試劑公司,其結構式見圖1[18]。實驗用水為Milli-Q水(Millipore, USA)。
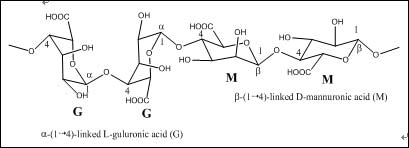
圖1. SA結構示意圖
2.2 電化學測試
實驗在三電極玻璃電解池中進行。工作電極為Q235鋼電極,其化學組成見表1,采用Araldite®環氧樹脂封裝,電極暴露面積0.196 cm2;輔助電極為鉑絲電極;參比電極是銀/氯化銀(Ag/AgCl, 3 M KCl)電極。工作電極在實驗前依次用400、600、800、1000號砂紙打磨,超聲清洗10 min,室溫干燥備用。電解質為3.5% NaCl溶液。電化學試驗,包括動電位極化曲線和EIS均在CHI760C電化學工作站(上海辰華)上進行。電化學實驗前將碳鋼電極浸泡在測試溶液中30 min直至開路電位(Eoc)穩定。所有測試均在室溫下進行。動電位極化曲線測試電位為-300到300 mV(vs. Eoc),掃描速度0.5 mV s−1。在極化方法中,公式1用于計算緩蝕效率(hp),其中i'corr和icorr分別是有和沒有緩蝕劑存在下的電流密度。
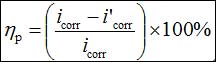 (1)
(1)
表1. Q235鋼化學組成
| C | Mn | Si | S | P | Fe |
| 0.10 | 0.40 | 0.12 | 0.02 | 0.05 | 99.31 |
在開路電位下進行EIS測試,頻率范圍105 Hz到10−1 Hz,振幅5 mV。采用ZSimpWin 3.10軟件分析EIS數據。緩蝕效率(hE)可以用下式計算:
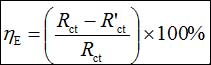 (2)
(2)
其中Rct 和R'ct分別是有和沒有緩蝕劑下的電荷轉移電阻。
3 結果與討論
3.1 動電位極化曲線分析
圖2給出Q235鋼電極在加有和不加有SA的3.5% NaCl溶液中的極化曲線,相應的電化學參數,包括腐蝕電位(Ecorr)和icorr列于表2。根據公式1計算的hp也列于表2。由表可見,隨著SA濃度的增大,icorr減小,Ecorr正移,在SA濃度為0.5 g L-1時,hp達到最大值94.3%。此外,進一步增大SA濃度,hp值將減小。這是由于SA為高分子化合物,增大濃度將會增大粘度,粘度的增大會影響其吸附性能,從而降低緩蝕效率。同時從表2中可以看到加入SA后Ecorr移動較大,根據Riggs Jr的研究結果[19],如果電位移動值大于85 mV,緩蝕劑將被認為是陽極型或陰極型緩蝕劑。在此研究中,腐蝕電位向正方向移動最大變化值達到136 mV,說明該緩蝕劑為陽極型緩蝕劑。SA在碳鋼電極表面吸附形成吸附膜,阻止腐蝕離子向金屬表面遷移,抑制陽極溶解,從而抑制腐蝕。
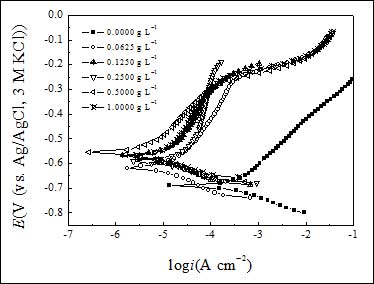
圖2. Q235鋼在含有不同濃度SA的3.5% NaCl溶液中的極化曲線
從圖2中SA濃度為0.5 g L−1時的陽極極化曲線可以看到當電極電位高于?250 mV時,陽極腐蝕電流隨電位增大迅速增大,這是由于金屬溶解導致SA吸附速率小于解吸速率[20]。
表2. 由圖2極化曲線得到的電化學參數
| Concentration (g L-1) |
-Ecorr (mV) |
icorr (μA cm-2) |
hp (%) |
| 0(blank) | 691 | 68.7 | - |
| 0.06 | 617 | 9.4 | 84.8 |
| 0.12 | 570 | 6.8 | 88.7 |
| 0.25 | 593 | 6.0 | 89.9 |
| 0.50 | 555 | 2.9 | 94.3 |
| 1.00 | 572 | 4.6 | 91.8 |
3.2 EIS分析
圖3給出了Q235鋼電極在加有和不加有SA的3.5% NaCl溶液中的Nyquist譜圖。這些曲線都表現為一壓縮半圓,這是由于電極表面粗糙度高和電流的幾何效用導致的的[21]。因此,在等效電路中,常相角元件(CPE)被用于替代純電容元件[22]。采用圖4所示等效電路對EIS數據進行合[23],擬合結果見表3。在這個模型中,Rs為溶液電阻,Rf為膜電阻,Rct為電荷轉移電阻。擬合數據和實驗數據有很好的擬合度。#p#分頁標題#e#
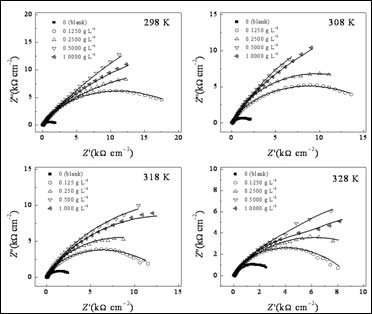
圖3. 不同溫度Q235鋼電極在含有不同濃度SA的3.5% NaCl溶液中Nyquist譜圖(實線代表擬合曲線)
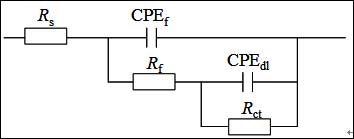
圖4. EIS擬合電路示意圖
表3. 由圖3EIS數據擬合得到的電化學參數
| T (K) |
C (g L-1) |
Qdl (μF cm-2) |
Rct (Ω cm2) |
hE (%) |
| 298 | 0.000 | 2660 | 149.4 | |
| 0.125 | 908 | 926.7 | 83.9 | |
| 0.250 | 894 | 1107.0 | 86.5 | |
| 0.500 | 868 | 2612.7 | 94.7 | |
| 1.000 | 879 | 1991.4 | 92.5 | |
| 308 | 0.000 | 5561 | 138.0 | |
| 0.125 | 1716 | 712.3 | 80.6 | |
| 0.250 | 1600 | 743.2 | 81.4 | |
| 0.500 | 1432 | 2148.2 | 93.6 | |
| 1.000 | 1610 | 1422.8 | 90.3 | |
| 318 | 0.000 | 5938 | 112.1 | |
| 0.125 | 1576 | 527.2 | 78.7 | |
| 0.250 | 1458 | 564.5 | 80.1 | |
| 0.500 | 1127 | 1393.0 | 92.0 | |
| 1.000 | 1333 | 1063.1 | 89.5 | |
| 328 | 0.000 | 5693 | 91.3 | |
| 0.125 | 1833 | 346.7 | 73.7 | |
| 0.250 | 1680 | 427.1 | 78.6 | |
| 0.500 | 1280 | 715.6 | 87.2 | |
| 1.000 | 1537 | 523.5 | 82.6 |
根據方程式2計算的不同濃度SA在不同溫度下的緩蝕效率列于表3。由表可見,在一定溫度下,SA的加入將減緩腐蝕過程,并且其作用隨溫度升高而降低。當溫度升高時,分子熱運動加速,SA分子在金屬表面的吸附/脫附平衡被打破,結果將導致緩蝕率降低。當濃度達到0.5 g L-1時,在298 K時SA的緩蝕效率達到最大94.7%。EIS結果與極化曲線結果一致。此外,從表中還可以看到,即使在高溫(328 K)下,其緩蝕效率還保持較高水平,說明該緩蝕劑可在較寬溫度范圍內使用。
3.3 吸附等溫線和熱力學參數
通常認為有機緩蝕劑分子在金屬溶液界面的吸附是一個取代表面吸附水的過程[11]:
Org(sol) + xH2O(ads) 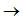 Org(ads) + xH2O(sol)
Org(ads) + xH2O(sol)
其中x為水分子被1摩爾有機分子的取代量。不同濃度SA在3.5% NaCl溶液中Q235鋼表面覆蓋度(θ)可被用于吸附等溫線研究,在這里,θ可被寫成[8]:
θ = hE/100(3)
吸附等溫線將提供SA分子在碳鋼表面的吸附過程信息。在此研究中,我們采用多種模型,包括Frumkin、Temkin、Freundlich和Langmuir對其進行擬合[11, 12]。根據這些吸附等溫式,θ與SA濃度關系可表示為:
Frumkin: log(θ/(1-θ)C) = logK + gθ(4)
Temkin: log(θ/C) = logK - gθ(5)
Freundlich: θ = KC(6)
Langmuir: C/θ = 1/K + C(7)
其中K 是吸附/脫附平衡常數。相應的擬合曲線見圖5。由圖可見,C/θ對C曲線為一直線,線性相關系數為0.9995,表明SA在碳鋼表面的吸附符合Langmuir吸附等溫線。此外,其他溫度得到的數據也符合Langmuir吸附等溫線(圖6)。
緩蝕劑分子的吸附自由能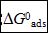 可由吸附/脫附平衡常數計算,而K值可以用下列方程求得[11]:
可由吸附/脫附平衡常數計算,而K值可以用下列方程求得[11]:
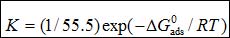 (8)
(8)
其中55.5是溶液中水的摩爾濃度,單位M,R是氣體常數,T是熱力學溫度。不同溫度下,通過Langmuir 吸附等溫線求得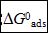 值列于表4。其值為負代表吸附過程為自發過程。通常,該值大于-20 kJ mol-1被認為是物理吸附過程;而小于-40 kJ mol-1被認為是化學吸附過程[11]。在表4中,
值列于表4。其值為負代表吸附過程為自發過程。通常,該值大于-20 kJ mol-1被認為是物理吸附過程;而小于-40 kJ mol-1被認為是化學吸附過程[11]。在表4中,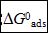 值的范圍在-47到-51 kJ mol-1之間,表示SA分子是化學吸附在碳鋼表面形成保護膜。從表4中還可以看出K值隨溫度升高而減小。K值通常表示SA分子的吸附能力,很明顯,在低溫時K值較大,說明低溫時吸附能力更強。因此,溫度升高將導致SA脫附,降低緩蝕效率。
值的范圍在-47到-51 kJ mol-1之間,表示SA分子是化學吸附在碳鋼表面形成保護膜。從表4中還可以看出K值隨溫度升高而減小。K值通常表示SA分子的吸附能力,很明顯,在低溫時K值較大,說明低溫時吸附能力更強。因此,溫度升高將導致SA脫附,降低緩蝕效率。
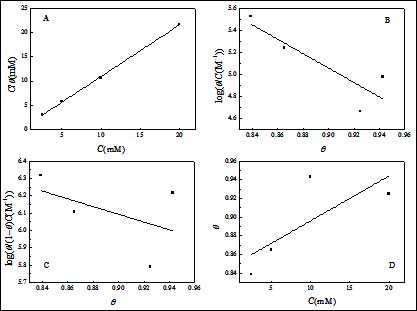
圖5. 298 K時SA在3.5% NaCl溶液中吸附等溫線(A:Langmuir,B:Temkin,C:Frumkin,D:Freundlich)
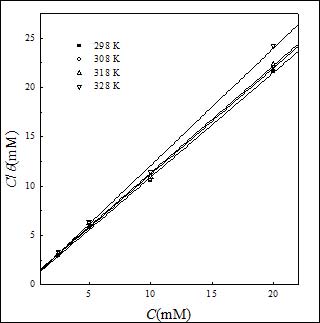
圖6. 不同溫度下C/θ與C關系曲線
吸附函ΔHads可通過Van't Hoff方程計算[24]:
 (9)
(9)
圖7給出了LnK對1/T關系直線,線性相關系數0.9677.在實驗條件下,吸附函可近似認為是標準吸附函(ΔH0ads)[24]。根據熱力學基本方程式DG0ads=DH0ads-TDS0ads可求出標準吸附熵ΔS0ads。
所有求出的熱力學參數列于表4。ΔH0ads值為負表明吸附過程為放熱過程,ΔS0ads值為負可以被解釋為SA分子取代水分子的吸附過程被認為是吸熱過程,將導致溶液熵減小,其對溶液也是適用的。得到的熱力學參數值是SA分子吸附和水分子脫附的加合。因此,熵增被認為是溶液熵增大的結果[25]。#p#分頁標題#e#
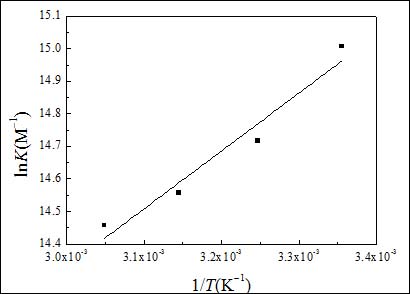
圖7. lnK與1/T關系曲線
表4. 根據Langmuir吸附等溫線計算的熱力學參數
| T | DG0ads | DH0ads | DS0ads |
| (K) | (kJ mol-1) | (kJ mol-1) | (J mol-1 K-1) |
| 298 | -47.13 | -14.80 | 108.49 |
| 308 | -47.97 | -14.80 | 107.69 |
| 318 | -49.11 | -14.80 | 107.89 |
| 328 | -50.40 | -14.80 | 108.54 |
4 結論
通過以上實驗結果分析與討論,可得到如下結論:
(1)SA對于Q235鋼在模擬海水(3.5% NaCl溶液)中的腐蝕是一類有效的緩蝕劑,特別是濃度為0.5 g L-1時,298 K時緩蝕率達94.7%。緩釋效率隨溫度升高而降低。
(2)極化曲線測試結果表明SA是一類陽極型緩蝕劑。
(3)EIS研究結果表明緩蝕劑在碳鋼表面的吸附增大電荷轉移電阻,起到緩蝕作用。極化曲線和EIS結果一致。
(4)SA分子在碳鋼表面吸附符合Langmuir吸附等溫線。吸附過程是一個自發和放熱過程。
References(參考文獻)
[1]Morad M. S. Effect of amino acids containing sulfur on the corrosion of mild steel in phosphoric acid solutions containing Cl, F and Fe3+ ions: Behavior under polarization conditions[J]. J. Appl. Electrochem., 2005, 35: 889-895.
[2]Moretti G., Guidi F., and Grion G. Tryptamine as a green iron corrosion inhibitor in 0.5 M deaerated sulphuric acid[J]. Corros. Sci., 2004, 46: 387-403.
[3]Aballe A., Bethencourt M., Botana F. J., et al. CeCl3 and LaCl3 binary solutions as environment-friendly corrosion inhibitors of AA5083 Al-Mg alloy in NaCl solutions[J]. J. Alloys Compd., 2001, 323: 855-858.
[4]Bethencourt M., Botana F. J., Cauqui M. A., et al. Protection against corrosion in marine environments of AA5083 Al-Mg alloy by lanthanide chlorides[J]. J. Alloys Compd., 1997, 250: 455-460.
[5]Bethencourt M., Botana F. J., Calvino J. J., et al. Lanthanide compounds as environmentally-friendly corrosion inhibitors of aluminum alloys: A review[J]. Corros. Sci., 1998, 40: 1803-1819.
[6]Arenas M. A., Bethencourt M., Botana F. J., et al. Inhibition of 5083 aluminum alloy and galvanised steel by lanthanide salts[J]. Corros. Sci., 2001, 43: 157-170.
[7]Giacomelli F. C., Giacomelli C., Amadori M. F., et al. Inhibitor effect of succinic acid on the corrosion resistance of mild steel: electrochemical, gravimetric and optical microscopic studies[J]. Mater. Chem. Phys., 2004, 83: 124-128.
[8]Fu J. J., Li S. N., Cao L. H., et al. l-Tryptophan as green corrosion inhibitor for low carbon steel in hydrochloric acid solution[J]. J. Mater. Sci., 2010, 45: 979-986.
[9]Cui R., Gu N., and Li C. Polyaspartic acid as a green corrosion inhibitor for carbon steel[J]. Mater. Corros., 2010, DOI: 10.1002/maco.200905511.
[10]Ashassi-Sorkhabi H. and Asghari E. Effect of hydrodynamic conditions on the inhibition performance of l-methionine as a “green” inhibitor[J]. Electrochim. Acta, 2008, 54: 162-167.
[11]Obot I. B., Obi-Egbedi N. O., and Umoren S. A. Antifungal drugs as corrosion inhibitors for aluminium in 0.1 M HCl[J]. Corros. Sci., 2009, 51: 1868-1875.
[12]de Souza F. S. and Spinelli A. Caffeic acid as a green corrosion inhibitor for mild steel[J]. Corros. Sci., 2009, 51: 642-649.
[13]Ozcan M., Solmaz R., Kardas G., et al. Adsorption properties of barbiturates as green corrosion inhibitors on mild steel in phosphoric acid[J]. Colloids Surf. A, 2008, 325: 57-63.
[14]Kardas G. and Solmaz R. Electrochemical investigation of barbiturates as green corrosion inhibitors for mild steel protection[J]. Corros. Rev., 2006, 24: 151-171.
[15]Raja P. B. and Sethuraman M. G. -Natural products as corrosion inhibitor for metals in corrosive mediaA review [J]. Mater. Lett., 2008, 62: 113-116.
[16]Quraishi M. A., Singh A., Singh V. K., et al. Green approach to corrosion inhibition of mild steel in hydrochloric acid and sulphuric acid solutions by the extract of Murraya koenigii leaves[J]. Mater. Chem. Phys., 2010, 122: 114-122.
[17]Abiola O. K., Otaigbe J. O. E., and Kio O. J. Gossipium hirsutum L. extracts as green corrosion inhibitor for aluminum in NaOH solution[J]. Corros. Sci., 2009, 51: 1879-1881.
#p#分頁標題#e#
[18]Drury J. L. and Mooney D. J. Hydrogels for tissue engineering: scaffold design variables and applications[J]. Biomaterials, 2003, 24: 4337-4351.
[19]Riggs Jr O. L. Corrosion Inhibitors[M]. Houston TX: NACE, 1973.
[20]Aksut A. A., Lorenz W. J., and Mansfeld F. The determination of corrosion rates by electrochemical D.C. and A.C. methods-II. Systems with discontinuous steady state polarization behavior[J]. Corros. Sci., 1982, 22: 611-619.
[21]Kendig M. W., Meyer E. M., Lidberg G., et al. A computer analysis of electrochemical impedance data[J]. Corros. Sci., 1983, 23: 1007-1015.
[22]De Levie R. The influence of surface roughness of solid electrodes on electrochemical measurements[J]. Electrochim. Acta, 1965, 10: 113-110.
[23]Salasi M., Shahrabi T., Roayaei E., et al. The electrochemical behaviour of environment-friendly inhibitors of silicate and phosphonate in corrosion control of carbon steel in soft water media[J]. Mater. Chem. Phys., 2007, 104: 183-190.
[24]Tang L., Mu G., and Liu G. The effect of neutral red on the corrosion inhibition of cold rolled steel in 1.0 M hydrochloric acid[J]. Corros. Sci., 2003, 45: 2251-2262.
[25]Ateya B. G., El-Anadouli B. E., and El-Nizamy F. M. The adsorption of thiourea on mild steel[J]. Corros. Sci., 1984, 24: 509-515.

官方微信
《中國腐蝕與防護網電子期刊》征訂啟事
- 投稿聯系:編輯部
- 電話:010-62313558-806
- 郵箱:fsfhzy666@163.com
- 中國腐蝕與防護網官方QQ群:140808414




