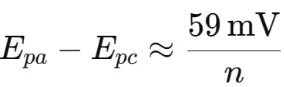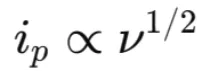循環(huán)伏安法(Cyclic Voltammetry, CV)是一種通過電位線性掃描并記錄電流響應來研究電化學過程的基本技術。在 CV 中,電極電位以設定的速率在一個范圍內往復變化,形成對稱的三角波信號,進而驅動電極界面的氧化還原反應。通過記錄電流-電位曲線(I-E 曲線),CV 能夠提供反應的熱力學、動力學和擴散等關鍵信息。
CV 的核心在于電極電位的動態(tài)控制和相應電流的記錄。這一過程基于三電極體系的精準設計:工作電極施加電位變化,參比電極提供穩(wěn)定的電位參考,對電極完成電流回路。在一次完整的三角波掃描中,電勢從初始電位逐漸掃描至終止電位后反向返回,完成一個氧化和還原循環(huán),形成經(jīng)典的伏安曲線。
本文將圍繞 CV 的核心原理展開,詳細解析電位與電流響應的關系、掃描速率對數(shù)據(jù)的影響,以及法拉第電流和非法拉第電流的區(qū)別。此外,本文還將介紹 Randles-Sevcik 方程及其在擴散控制條件下的應用,探索氧化還原峰、峰電流及峰面積等特征背后所揭示的物理化學信息。這些內容將為理解循環(huán)伏安法在電化學研究中的重要性提供理論基礎,并為后續(xù)的實驗設計與數(shù)據(jù)分析奠定堅實的理論框架。
1 循環(huán)伏安法簡介
1.1 循環(huán)伏安法的基本定義
循環(huán)伏安法(Cyclic Voltammetry, CV)是通過對工作電極施加線性掃描電位,記錄與電位相關的電流變化來分析電化學行為的一種方法。其核心特性在于通過電流-電位曲線(I-E 圖),捕捉氧化還原反應的動力學與熱力學信息,為研究電化學過程提供了強有力的工具。
圖表來源:Mohammad R, Abrams D J, Cardinale L Z A S S.Cyclic voltammetry and chronoamperometry: mechanistic tools for organic electrosynthesis[J].Chemical Society Reviews, 2024, 53(2):566-585.
在電化學領域,CV的應用十分廣泛,從簡單的氧化還原反應分析,到復雜的材料表征、催化性能評估和腐蝕行為研究,都有CV的身影。與其他電化學方法相比,CV具有以下優(yōu)勢:
?操作簡單:通過參數(shù)設置,可以快速獲得氧化還原反應的全貌。
?數(shù)據(jù)豐富:單一實驗即可提供熱力學、動力學及擴散行為等多方面信息。
?靈活性高:可通過多循環(huán)掃描探測動態(tài)過程,還可以結合其他方法如電化學阻抗譜(EIS)或原位表征技術擴展應用范圍。
1.2 循環(huán)伏安法的歷史背景
CV 的起源可以追溯到 20 世紀初。最初,它是作為線性掃描伏安法(Linear Sweep Voltammetry, LSV)的延伸技術開發(fā)的。早期的研究主要集中在簡單的氧化還原體系中,通過手動掃描電位和記錄電流信號完成實驗。
然而,20 世紀中葉,隨著電化學理論的發(fā)展和高精度儀器的出現(xiàn),CV逐漸成為電化學研究的核心工具。其中,Randles 和 Sevcik 的工作奠定了 CV 的理論基礎:
?Randles-Sevcik 方程用于定量描述擴散控制反應的峰電流。
?現(xiàn)代電化學工作站的發(fā)明,如 Autolab 和 CHI 系列儀器,使得高分辨率數(shù)據(jù)采集成為可能,進一步推動了 CV 的普及。
目前,CV 已不僅局限于傳統(tǒng)的無機氧化還原反應研究,其應用范圍涵蓋了新能源、電化學傳感、生物化學和腐蝕科學等多個領域。
1.3 循環(huán)伏安法的理論基礎
CV 的實驗設計基于以下兩個核心電化學概念:
?法拉第電流(Faradaic Current):由電極表面發(fā)生的氧化還原反應產(chǎn)生,與電子轉移過程直接相關。
?非法拉第電流(Non-Faradaic Current):由電極表面雙電層電容充放電產(chǎn)生,與化學反應無關。
在 CV 實驗中,法拉第電流是研究的重點,其大小、方向和變化趨勢反映了界面氧化還原反應的本質。CV 測試的結果通常以電流-電位曲線呈現(xiàn),其中包含以下關鍵信息:
●氧化還原峰:由電化學反應產(chǎn)生,峰電位反映反應的熱力學特征。
●峰電流:與反應物擴散速率、電極表面積和電子轉移動力學相關。
●循環(huán)特性:通過多次掃描觀察電流-電位曲線的變化,評估界面的穩(wěn)定性或反應的可逆性。
1.4 循環(huán)伏安法的應用范圍
CV 的應用廣泛且多樣,以下是幾個典型領域:
?腐蝕研究
CV 可用于分析金屬表面的氧化還原行為,例如鐵或鋅的鈍化膜穩(wěn)定性。在研究腐蝕機理時,CV 可以通過峰位變化監(jiān)測腐蝕產(chǎn)物的生成或破壞過程。
○案例:研究鋅鋁鎂(ZAM)鍍層鋼板在鹽霧條件下的電化學行為,通過CV曲線中的氧化峰位推測鈍化膜的組成。
?材料表征
CV 廣泛應用于鋰電池、超級電容器等能源材料領域,用以評估電極材料的可逆性和比容量。
○案例:評估鈷氧化物薄膜電極的氧化還原活性,觀察循環(huán)中 CV 曲線面積的變化以衡量材料的循環(huán)穩(wěn)定性。
?催化劑研究
CV 可用于研究電催化劑的活性,例如析氫反應(HER)或析氧反應(OER)的催化劑性能。
○案例:分析鉬基催化劑的 HER 活性,觀察在特定電位范圍內的氧化還原行為,并通過峰面積評估催化活性位點的數(shù)量。
?生物傳感與電化學分析
CV 用于研究生物分子的氧化還原反應,例如葡萄糖、酶或DNA的電化學行為。
○案例:通過修飾電極表面研究DNA分子在不同氧化還原狀態(tài)下的電子轉移特性。
1.5 循環(huán)伏安法的優(yōu)勢與局限性
?優(yōu)勢
○信息豐富:單次實驗即可獲取熱力學、動力學及擴散相關信息。
○適用范圍廣:對固體、液體及界面反應均適用。
○直觀性強:通過 CV 曲線的形態(tài)和變化,可以快速判斷反應的特性。
?局限性
○受限于分辨率:在復雜體系中,多個重疊反應可能導致數(shù)據(jù)解析困難。
○環(huán)境影響顯著:如溶液電導率、溫度等實驗條件對數(shù)據(jù)有顯著影響。
○需結合其他技術:CV 的數(shù)據(jù)往往需要與其他方法(如 EIS 或原位表征技術)結合,才能全面揭示反應機理。
循環(huán)伏安法作為電化學研究的經(jīng)典方法,以其簡單的實驗操作和豐富的數(shù)據(jù)呈現(xiàn)成為電化學界的核心工具。通過合理設計實驗參數(shù),CV 能夠在多領域中揭示氧化還原反應的核心規(guī)律。接下來,本文將從原理、實驗設置與優(yōu)化、數(shù)據(jù)解析及應用案例等方面進一步探討 CV 的科學內涵與應用前景。
2 循環(huán)伏安法的核心原理
2.1 電極電位的線性掃描原理
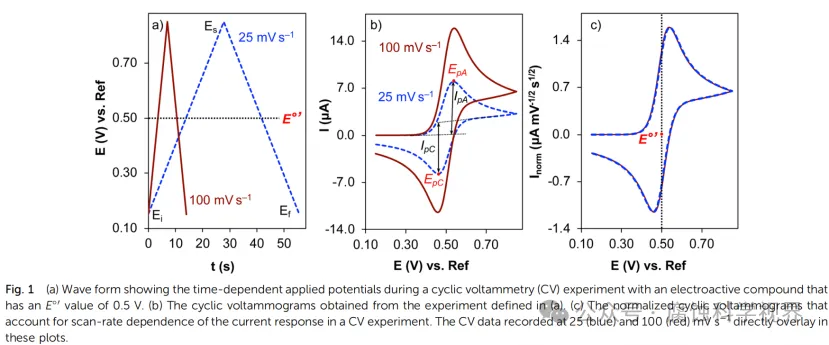
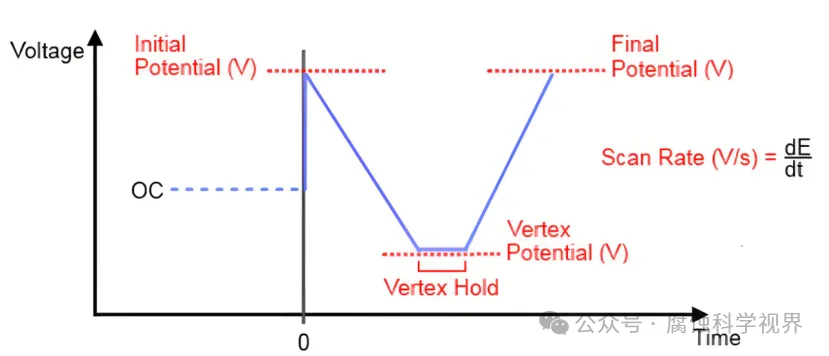
在循環(huán)伏安法(CV)中,工作電極的電位以線性速率在設定的范圍內往復變化,形成對稱的三角波信號。這種電位的動態(tài)變化驅動了電極界面的氧化還原反應,從而生成對應的電流信號。電極電位的控制和電流響應的記錄構成了CV的基本實驗框架。
CV的測量原理是使電勢在工作電極上作三角波掃描的同時,即電勢以給定的速率u從起始電勢Ea掃描到終止電勢Ex后,再以相同速率反向掃描至Eo,并記錄相應的電流-電勢(i-E)曲線,也稱伏安曲線 ,入為電勢換向時間。電勢與時間的關系可表示為:E=Eo+ut。式中,u為掃描速度,t為掃描時間。在一次三角波電勢掃描過程中,完成一個氧化和還原的循環(huán)過程,故稱為循環(huán)伏安法。
2.1.1 電位控制機制
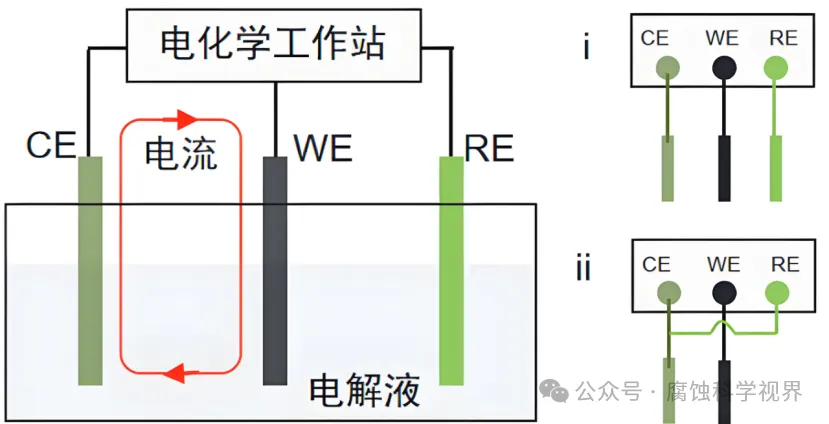
CV 實驗中使用的三電極體系能夠精確控制電極電位:
工作電極(Working Electrode, WE):施加電位變化的主體,是反應發(fā)生的主要場所。
參比電極(Reference Electrode, RE):提供穩(wěn)定的參考電位,確保工作電極的電位精確可控。
對電極(Counter Electrode, CE):完成電流回路,通常由高導電材料(如鉑絲或石墨)制成。
通過電化學工作站,工作電極電位以線性速率掃描,掃描范圍通常覆蓋氧化和還原過程的電位區(qū)間,例如從 −1.0 V-1.0V 的區(qū)間。
2.1.2 掃描速率的影響
掃描速率(ν)是 CV 實驗的重要參數(shù)之一,它決定了氧化還原過程的響應時間:
○慢速掃描(ν≤10 mV/s):有助于探測反應的熱力學信息,例如氧化還原電位的精確測定。
○快速掃描(ν≥100 mV/s):適合研究瞬態(tài)過程和動力學行為,例如表面吸附過程。
實際應用中,掃描速率的選擇需根據(jù)目標反應的特性和研究目的進行優(yōu)化。
2.2 界面反應與電流響應
CV 中的電流信號主要來源于電極界面的兩種過程:
法拉第電流(Faradaic Current):由電極表面的氧化還原反應引起,與電子轉移直接相關。
非法拉第電流(Non-Faradaic Current):由雙電層電容充放電產(chǎn)生,與化學反應無關。
2.2.1 法拉第電流的特性
法拉第電流反映了界面氧化還原反應的本質,其大小受以下因素影響:
○擴散:反應物從溶液體相擴散到電極表面的過程。
○電子轉移速率:由電極與反應物之間的界面動力學決定。
○反應可逆性:可逆反應中,電子轉移速率足夠快,法拉第電流呈現(xiàn)對稱峰值;不可逆反應中,峰值發(fā)生位移且峰電流減小。
2.2.2 擴散控制與動力學控制
CV 中的反應過程可以根據(jù)主導因素分為兩類:
○擴散控制反應:電流大小由反應物向電極擴散的速率決定,表現(xiàn)為峰電流 (ip) 與掃描速率的平方根 (ν1/2) 成正比。
○動力學控制反應:電流大小由界面電子轉移速率決定,通常與掃描速率呈線性關系。
2.2.3 Randles-Sevcik 方程
擴散控制條件下,法拉第電流可以通過 Randles-Sevcik 方程描述:
通過此方程,可以定量研究反應物的擴散特性及界面反應的動力學信息。
2.3 電流-電位曲線的特征
CV 測試的結果通常以電流-電位曲線(I-E 圖)呈現(xiàn),曲線的形態(tài)反映了電化學反應的主要特性。以下是 CV 圖譜中的幾個關鍵特征:
2.3.1 氧化還原峰
在 CV 曲線中,電位掃描至氧化還原反應發(fā)生時,會出現(xiàn)明顯的電流峰:
○氧化峰(Epa):對應電極表面發(fā)生氧化反應的電位。
○還原峰(Epc):對應電極表面發(fā)生還原反應的電位。
○峰電位差(ΔEp=Epa−Epc):反映反應的可逆性,理想可逆反應中 ΔEp≈59 mV/n。
2.3.2 峰電流與反應物濃度
峰電流的大小與溶液中反應物的濃度成正比,因此 CV 常用于定量分析:
在已知擴散系數(shù)和電極面積的情況下,可以通過峰電流計算溶液中反應物的濃度。
2.3.3 多循環(huán)特性
多次掃描可揭示反應的動態(tài)行為,例如電極材料的表面變化或吸附行為。以下是常見的多循環(huán)特征:
○可逆反應:氧化和還原峰保持對稱,峰電流和峰面積基本穩(wěn)定。
○不可逆反應:隨著循環(huán)次數(shù)增加,峰電流逐漸減小或峰位置發(fā)生位移,表明反應產(chǎn)物對電極表面的覆蓋效應。
2.4 理論模型與數(shù)學描述
為了進一步解析 CV 圖譜,通常需要結合數(shù)學模型對實驗數(shù)據(jù)進行擬合和解釋。
2.4.1 可逆反應的數(shù)學描述
對于可逆反應,峰電位和峰電流的關系可以通過以下公式描述:
n:轉移電子數(shù)。
理想情況下,可逆反應的氧化還原峰對稱分布,且峰電位差為常數(shù)。
2.4.2 擴散控制的動力學模型
在擴散控制條件下,峰電流與掃描速率平方根的關系為:
通過對峰電流和掃描速率的關系作圖,可以區(qū)分擴散控制與動力學控制的主導機制。
2.4.3 Tafel 方程
對于動力學控制的不可逆反應,Tafel 方程用于描述電流與電位的關系:
結合 CV 數(shù)據(jù)和 Tafel 方程,可以進一步量化界面的電子轉移速率。
循環(huán)伏安法的核心原理基于電位的線性掃描和對應的電流響應。通過電流-電位曲線的特征分析,可以定量研究氧化還原反應的動力學和熱力學性質。無論是可逆反應的熱力學信息,還是不可逆反應的動力學行為,CV 都提供了豐富的數(shù)據(jù)支持。下一部分將詳細討論實驗設計與參數(shù)優(yōu)化,確保測試結果的科學性和可靠性。
免責聲明:本網(wǎng)站所轉載的文字、圖片與視頻資料版權歸原創(chuàng)作者所有,如果涉及侵權,請第一時間聯(lián)系本網(wǎng)刪除。

官方微信
《腐蝕與防護網(wǎng)電子期刊》征訂啟事
- 投稿聯(lián)系:編輯部
- 電話:010-62316606
- 郵箱:fsfhzy666@163.com
- 腐蝕與防護網(wǎng)官方QQ群:140808414