金屬電化學腐蝕傾向的判斷
文/林玉珍·北京化工大學
金屬電化學腐蝕過程是金屬和它周圍的電解質環境所組成的體系,從一個熱力學不穩定狀態過渡到熱力學穩定狀態的過程,其結果是生成各種化合物,同時引起了金屬結構的破壞。例如:把鐵片浸入鹽酸溶液中,立即可見有氫氣放出,同時鐵會以相同于氫放出的速度而溶解到溶液中,即鐵發生了腐蝕。又如把紫銅片放入不含溶解氧的鹽酸溶液中時,卻見不到有氫氣放出,銅片也不發生溶解而腐蝕溶液。但是鹽酸中一旦有氧溶解進去后,就能見到紫銅片不斷遭受著腐蝕。此時仍然看不到有氫氣放出,如圖1所示。
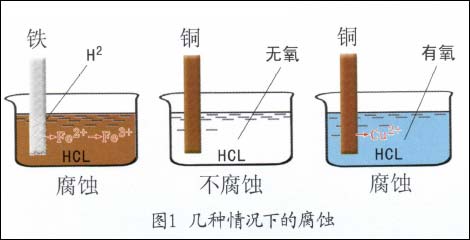
這就要問,為什么不同金屬在同一種介質中的腐蝕行為不一樣?又為什么同一金屬在不同的介質中腐|蝕情況也不相同?那么造成金屬電化學腐蝕不同傾向的原因是什么?究竟應如何判斷?這些對于討論腐蝕問題至關重要。為了搞清這些問題,首先必須了解電極、電極反應、電極電位等基本概念,還要進一步了解它們與金屬腐蝕傾向之間存在的關系。
電極與電極反應
在腐蝕學科研究中,電極往往是指金屬(電子導體相)與電解質溶液(離子導體相)這兩種不同類導體組成的體系,亦稱為電極系統,以“金屬/電解質溶液”表示。它不只是指電子導體材料。如果在電極系統的兩相之間伴有電荷的轉移,則不可避免地同時會在兩相間的界面上發生物質變化一一由一種物質變為另一種物質,即化學變化。
因此,在電極系統中,伴隨著兩個不同類導體之間的電荷轉移在兩相界面上發生的化學反應,稱為電極反應。例如:
鋅電極(Zn/ZnSO4):一個鋅棒浸在硫酸鋅溶液中組成的電極系統。此時,電子導體是金屬鋅,離子導體是ZnSO4溶液。當兩相之間發生電荷轉移時,在兩相的界面上,即在與溶液接觸的Zn表面上同時會發生如下的物質變化。
式中右下角括號中標注的是該物質所存在的相,e表示電子。由于金屬本身參加了反應,故又稱金屬電極(圖2a)。
氫電極(Pt,H2/HC1):一塊鍍鉑黑的鉑片浸在H2氣體下的HC1溶液中組成的電極系統。此時,電子導體相是Pt,而離子導體相是HC1水溶液。兩相界面上有電荷轉移時發生的電極反應是:

由于反應中有氣體成份,故該電極又可能為氣體電極(圖2b)。
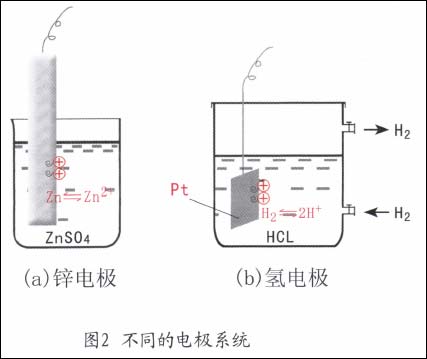
在電極系統中,兩相之間電荷轉移后就產生了所謂的雙電層,雙電層的電位差就是金屬與電解質溶液之間的電位差,稱為該電極的電極電位,用E表示之。
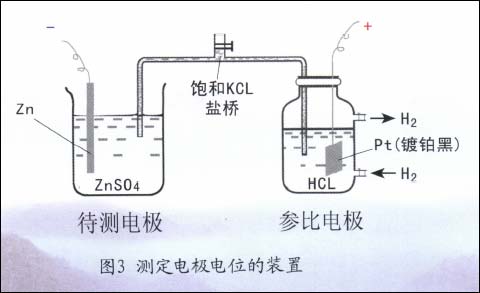
值得注意的是,這種單電極的電位,荷電的一方為金屬側,另一方為溶液側,故其絕對電極電位值是無法直接測得的。因此,實際測量某金屬的電極電位(如Zn電極)時,必須另找一個具有恒定電位值的單電極系統(如氫電極系統)作為基準(參比電極)與之組成原電池(圖3),測出原電池的電動勢從而獲得待測電極(Zn電極)相對于氫電極參比電極的電極電位。今后用E表示的均為相對電極電位。
免責聲明:本網站所轉載的文字、圖片與視頻資料版權歸原創作者所有,如果涉及侵權,請第一時間聯系本網刪除。
-
標簽: 腐蝕電化學金屬傾向判斷

官方微信
《腐蝕與防護網電子期刊》征訂啟事
- 投稿聯系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 腐蝕與防護網官方QQ群:140808414





