平衡電極電位與非平衡電極電位
任何一個電極反應,伴隨著兩類導體相之間電荷的轉移同時在兩相界面上會發生氧化還原反應。
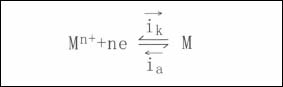
通常,失去電子本身被氧化的反應稱之為氧化反應(亦稱為陽極反應);奪取電子本身被還原的反應稱為還原反應(亦稱為陰極反應)。根據法拉第定律,電極反應的速度可用電流密度來表示。式中的 和
和 分別稱為該電極反應的陰極和陽極反應的電流密度。
分別稱為該電極反應的陰極和陽極反應的電流密度。
平衡電極電位
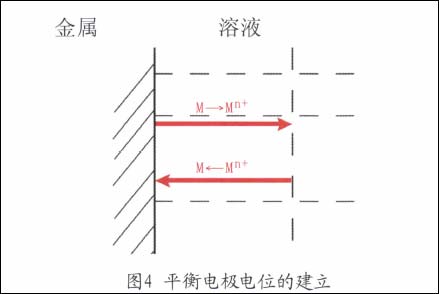
如果在一個電極表面只進行如上所表示的一個電極反應,當這個電極反應處于平衡狀態時,其電極電位能達到一個恒定不變的數值,這就是該電極反應的平衡電極電位Ee(如圖4所示)。
此時,其陰極反應的速度和陽極反應的速度相等,即:
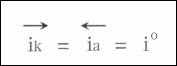
稱為該電極反應的交換電流密度,它表明在平衡電位下,正、逆反應的交換速度。任何一個電極反應處于平衡狀態時都有它自己的r,它是電極反應一個主要的動力學參數。
平衡電位表明金屬與溶液界面已建立起可逆平衡狀態,即電荷與物質從金屬向溶液遷移的速度和從溶液向金屬遷移的速度都相等,即物質和電荷交換都平衡。因此,電極體系不會出現宏觀的物質變化,沒有凈反應發生,也沒有凈電流出現,即既沒有電流從外線路流入電極系統,也沒有電流自電極向外線路流出。所以,金屬放入含有其本身離子的溶液中,處于平衡狀態時,金屬是不會腐蝕的。例如,純Zn放入ZnSO4溶液中和純銅放入CuSO4溶液中構成的平衡鋅電極和平衡銅電極,當它們分別孤立地存在時,它們不發生腐蝕。
如果在標準狀態(即參加電極反應物質的活度a=1)時,將各種電極分別與標準氫電極組成一個電池,測得電池的電動勢就分別是各電極的標準相對的平衡電極電位Ee0,它是以標準氫電極電位為零的相對值。常把各種可逆電極的標準相對平衡電極電位(簡稱標準平衡電位),按自上而下從負到正值的次序排列的表稱為電動序(相關的資料中均能查到)。平衡電位與金屬在溶液中的離子活度關系可用能斯特Nernst公式進行計算,也可用實驗方法測得。
非平衡電極電位
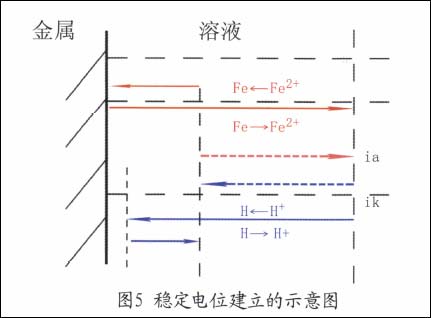
如果在一個電極表面進行著兩個或兩個以上的電極反應時,這種電極系統也能達到一個相對穩定的狀態,此時的電極電位稱之為非平衡電極電位E(亦稱穩定電位)。例如,鐵放入稀酸溶液中的情況如圖5所示。

此時電極上進行著兩個電極反應:
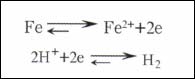
當電極系統穩定時,以上的兩個電極反應中,一個是按這一電極過程的陽極反應方向,一個是按另一電極過程的陰極反應方向以相等的速度進行。因此,穩定電位的建立表征反應在電極上都已偏離了各自的平衡狀態。此時電極上失去電子是靠某一電極過程,而得到電子則靠另一電極過程。這就表明,電極系統中兩相間電荷交換達到了平衡。但是,參加電極反應的物質交換都不平衡。
一個孤立的電極上,同時以相等速度進行著一個電極過程的陽極反應和另一電極過程的陰極反應的現象稱為電極反應的耦合,而互相耦合的反應稱為共軛反應,相應的電極系統稱為共軛體系。體系中,這一對共軛反應都偏離了各自反應的平衡電極電位,同在非平衡電極電位E的數值下進行,電位E是在互相耦合的這兩個電極反應的平衡電極電位數值之間,即:
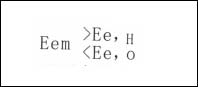
亦稱為混合電位。該電極電位不服從Nernst公式,不能計算,只能用實驗方法測得。
如果這一對耦合的電極反應中,陽極反應是金屬材料的陽極溶解(見圖5),其結果導致金屬(Fe)的腐蝕破壞。在腐蝕領域中,經常涉及到的是非平衡體系,非平衡電極電位在腐蝕及其控制的研究中有著重要的意義。
免責聲明:本網站所轉載的文字、圖片與視頻資料版權歸原創作者所有,如果涉及侵權,請第一時間聯系本網刪除。
-
標簽: 腐蝕電化學金屬傾向判斷

官方微信
《腐蝕與防護網電子期刊》征訂啟事
- 投稿聯系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 腐蝕與防護網官方QQ群:140808414





