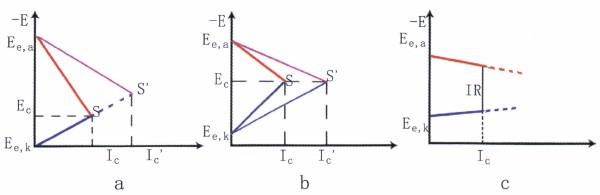
圖9工作控制情況下的腐蝕極化圖
② 陽極控制的腐蝕過程。如圖9a所示,這類腐蝕,陽極極化曲線很陡,陽極反應阻力大,控制著腐蝕速度。如溶液中能形成穩定鈍態的金屬和合金的腐蝕就是陽極控制腐蝕過程的典型例子。破壞鈍態的各種因素均促進腐蝕的陽極反應,從而導致腐蝕顯著增大。③混合控制的腐蝕過程。如圖9b所示,如果體系的歐姆電阻可以忽略,而陰極極化和陽極極化的程度相差不大,腐蝕受陰、陽極混合控制。例如鋁和不銹鋼在不完全鈍化的狀態下的腐蝕屬此類。
④歐姆電阻控制的腐蝕。如圖9c所示,當通過腐蝕電流表Ic時,相應體系中產生的歐姆助降為IcR,R為系統的總電阻,實質上就等于溶液的電阻。例如地下管線或土壤中金屬結構的腐蝕以處于高電阻率的溶液中的金屬構件,當它們在溶液相中相距較遠時發生的腐蝕都屬腐蝕過程。
揭示腐蝕過程中的控制步驟,并在其中設置障礙,進—步增大極化,是控制腐蝕的有效途徑。
(2)解釋腐蝕現象。

圖10不同因素對腐蝕的影響
僅舉幾例,如圖10所示。鋅在稀硫酸中的腐蝕見圖10a。在鋅上析氫過電位高,反應阻力大,屬于陰極控制腐蝕。如Cu作為雜質在鋅中存在,由于Cu上氫過電位比Zn上的要低,使析H2反應容易,從而增|大了Zn的腐蝕。而Hg上氫過電位要比Zn上的高,所以Hg在Zn中存在,使氫的析出更困難,從而降低了鋅的腐蝕即:IC(Hg)< IC (Zn)< IC (Cu)
硫化物對碳鋼在酸溶液中的腐蝕,見圖10c,酸中硫化氫的存在會促進碳鋼的陽極反應,降低陽極極化,從而加速碳鋼的腐蝕,即:Ic1<Ic2<IC3
氧和C1-對碳鋼在稀硫酸中的腐蝕性能的影響和不銹鋼類似。由于鋁在充氣的稀硫酸中能產生鈍化現象,腐蝕速度較小,當溶液中去氣后,鋁的鈍化程度顯著變差,陽極極化率變小,腐蝕也增大。當溶液中含活性Cl-時,鈍態被破壞,腐蝕大大加劇。
(3)確定陰極保護的可行性,選取保護參數。
由圖11可知,該腐蝕是陰極控制腐蝕過程,由此進—步增大陰極極化,容易獲得有效的腐蝕控制,故采用陰極保護技術合理、可行。
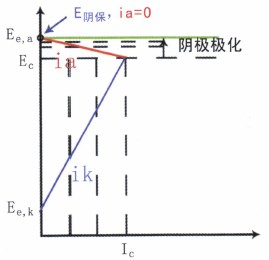
圖11 陰極保護的可行性
所謂陰極保護,不管是用犧牲陽極還是外加電流法來實現,其實質就是將被保護設備變成“陰極”,使之陰極極化以達到控制腐蝕的目的。由于陰極電流的通過,被保護設備的電位從腐蝕電位EC開始負移,腐蝕陽極反應的電流ia隨之減小,腐蝕減小。當電位移到陽極反應的起始電位Ee,a時,ia=0,腐蝕停止。陰極保護效率達100%。理論上這就是最小陰極保護電位E陰保
實際工程中實施陰極保護時,并不單純追求100%的保護,還必須考慮:
在E陰保下,是否發生副反應(如H的析出)對設備及其上的涂層有損傷。
在E陰保下是否電能消耗過大,不經濟。
總之,要綜合分析,并在有較好的保護度下選取合理的保護參數為好。
另外,在研究緩蝕劑等方面也都會用到腐蝕極化圖。
由上可見,腐蝕極化圖在腐蝕及其控制的研究中是重要的工具,其用途廣泛。
免責聲明:本網站所轉載的文字、圖片與視頻資料版權歸原創作者所有,如果涉及侵權,請第一時間聯系本網刪除。
-
標簽: 腐蝕金屬極化作用
相關文章
無相關信息

官方微信
《腐蝕與防護網電子期刊》征訂啟事
- 投稿聯系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 腐蝕與防護網官方QQ群:140808414
點擊排行
PPT新聞
“海洋金屬”——鈦合金在艦船的
點擊數:8135
腐蝕與“海上絲綢之路”
點擊數:6475





