摘要
以過硫酸銨-亞硫酸氫鈉為引發劑,將丙烯酰胺單體接枝到淀粉上制備了淀粉接枝共聚物 (St-g-PAM),可作為一種新型“綠色”緩蝕劑。通過失重實驗和電化學測試研究了St-g-PAM對1.0 mol/L HCl溶液中Zn的緩蝕效果。結果表明,St-g-PAM在HCl溶液中對Zn具有較好的緩蝕性,是一種混合抑制型緩蝕劑。緩蝕率隨St-g-PAM質量濃度的增加而增大;但當濃度超過50 mg/L時,緩蝕率增加變緩慢。在20~50 ℃下,St-g-PAM在Zn表面的吸附過程與Langmuir吸附模型一致。動電位極化曲線和電化學阻抗測試結果表明,St-g-PAM在HCl溶液中對Zn有較好的緩蝕作用,表現為St-g-PAM存在條件下,Zn腐蝕電流密度減小,電荷轉移電阻增大。
關鍵詞: 淀粉接枝共聚物; Zn; 緩蝕劑; 緩蝕機理
Zn是一種重要的有色金屬,廣泛用于鋼鐵、汽車、造船、家用電器、電池等工業領域。鹽酸溶液常用于Zn表面的酸洗和清潔,當暴露在酸溶液中時,Zn表面極容易受到腐蝕[1]。添加緩蝕劑是一種操作簡單、成本低廉、適用范圍廣的金屬緩蝕方法[2]。最常見的金屬緩蝕劑是氮、氧或含硫有機化合物[3]。然而,其中一些緩蝕劑對環境危害很大,如硫脲類、亞硝酸鹽及磷酸鹽等[4],因此開發價廉、易得、高效、環境友好型緩蝕劑受到研究者的關注,是金屬緩蝕劑的研究熱點和發展方向[5]。與低分子化合物相比,高分子聚合物作為緩蝕劑具有持續時間長、高效環保等優點。聚合物作為Zn的緩蝕劑已有相關報道,如聚乙二醇600 (PEG 600) 和聚山梨酯20 (Tween 20) 復合緩蝕劑[6]、羥乙基纖維素 (HEC)[7]等對Zn具有較好的緩蝕作用。
淀粉是一種廉價、豐富的自然資源,容易通過在主鏈上引入各種官能團進行化學改性,以滿足不同的應用目的[8]。將丙烯酰胺單體接枝到淀粉大分子上,生成丙烯酰胺淀粉接枝共聚物,引入了含N的官能團,使其既具有天然淀粉的性能,還具有合成高分子的優良特性,從而增強了吸附性能,會產生良好的緩蝕作用。付惠等[9]研究表明,淀粉接枝共聚物在1.0 mol/L HCl溶液中對鋼具有良好的緩蝕作用,緩蝕率隨緩蝕劑濃度增加而增大,且在鋼表面的吸附符合Langmuir吸附等溫式。李向紅等[10]研究了木薯淀粉接枝共聚物 (CSGC)、木薯淀粉 (CS) 和丙烯酰胺 (AA) 在1.0 mol/L HCl溶液中對Al的緩蝕作用,CSGC的緩蝕效果明顯優于單獨使用CS和AA的緩蝕性能;當CSGC用量為50 mg/L時,緩蝕率達90%以上。淀粉接枝共聚物作為緩蝕劑用于防止金屬腐蝕中,可滿足緩蝕性能的需要,豐富緩蝕劑的種類。
本文以過硫酸銨-亞硫酸氫鈉為引發劑,制備了丙烯酰胺淀粉接枝共聚物,采用失重法和電化學測試方法研究了St-g-PAM在1.0 mol/L HCl溶液中對金屬Zn的緩蝕性能。通過改變緩蝕劑濃度和溫度探究了St-g-PAM緩蝕性能的影響因素,系統性地計算了吸附熱力學和腐蝕動力學參數,以此分析緩蝕劑在Zn表面的吸附行為和緩蝕機理。
1 實驗方法
1.1 St-g-PAM的制備
將5 g淀粉和100 mL蒸餾水加入含冷凝管、溫度計、攪拌裝置的四口燒瓶,通入N2,在80 ℃下糊化30 min。糊化完成后,將體系降溫至40 ℃,加入15 g丙烯酰胺,穩定10 min,加入6 mmol/L過硫酸銨-亞硫酸氫鈉溶液,攪拌反應3 h。反應完成后,用無水乙醇將產物析出,靜置30 min,抽濾,得到白色沉淀;在60 ℃下真空干燥至恒重,得粗產品。將粗產品粉碎、研磨后,用濾紙包裹,放置Soxhlet提取器中,用丙酮回流抽提12 h,以除去均聚物;再用無水乙醇多次洗滌,60 ℃下真空干燥至恒重,得到精制的淀粉接枝共聚物[10]。
1.2 St-g-PAM的結構表征
采用FTS-135紅外光譜儀 (FTIR) 對St-g-PAM的結構進行分析測定,用KBr壓片法,測量范圍為400~4000 cm-1。
1.3 失重法
將鋅片剪裁成2 cm×2 cm×0.3 mm大小,用砂紙將500#、800#、1000#鋅片打磨至光亮,依次用丙酮、無水乙醇和去離子水洗滌,干燥后分別浸泡在1.0 mol/L含不同質量濃度緩蝕劑的HCl溶液中。恒溫2 h后取出鋅片,洗滌,干燥至恒重后再次稱重。每個Zn試樣測定3次,計算平均值以減少誤差,腐蝕速率ν和緩蝕效率η根據下式計算:

式中,m1和m2分別為鋅片腐蝕前、后的質量,g;S為鋅片的表面積,m2;t為腐蝕時間,h;νcorr和νcorr(inh) 分別為未添加和添加緩蝕劑鋅片的腐蝕速率,g/(m2·h)。
1.4 電化學方法
采用CHI660D電化學工作站三電極體系進行電化學測試。參比電極為飽和甘汞電極,輔助電極為Pt電極,工作電極為Zn電極。Zn電極的制作過程為:將鋅片裁成1.0 cm×1.0 cm大小,分別用500#、1000#、2000#砂紙將鋅電極的裸露測試面打磨至光亮,再分別用水和丙酮沖洗。將非工作面用環氧樹脂灌封,干燥放置。測試前,將電極放入測試溶液中30 min以達到穩定狀態。在20 ℃下測試,極化曲線掃描速率為1 mV/s,極化范圍為-250~250 mV (相對于開路電壓)。電化學阻抗頻率范圍為105~10-2 Hz,交流信號幅值為10 mV。
1.5 形貌觀察
將2 cm×2 cm×0.3 mm的鋅片按失重法進行表面處理后,置于恒溫20 ℃的1.0 mol/L HCl溶液中,浸泡2 h后取出。用蒸餾水沖洗、干燥后,分別用S-4800-I型掃描電子顯微鏡 (SEM) 和Dimension Edge,Bruker型原子力顯微鏡 (AFM) 對表面進行觀察。
2 結果與討論
2.1 St-g-PAM的結構表征
由圖1所示,未接枝淀粉 (見光譜a) 在3430 cm-1處的寬吸收峰是—OH的伸縮振動,2929 cm-1處為飽和C—H伸縮振動吸收峰,1020,1082和1162 cm-1處顯示出了淀粉中伯醇、仲醇和醚鍵3個特征吸收峰,1647 cm-1處的峰值是由于淀粉無定形區的吸水性,934 cm-1附近為葡萄糖環的伸縮振動峰。接枝淀粉 (見光譜b) 光譜中均顯示出淀粉的特征峰。此外,3423 cm-1附近出現—OH和—NH2疊加形成的特征峰,1675 cm-1為新增酰胺上C=O的伸縮振動吸收峰,1613 cm-1處為N—H的伸縮振動峰,1100~1300 cm-1為C—N的吸收峰[11]。以上結果表明反應生成了淀粉接枝共聚物。
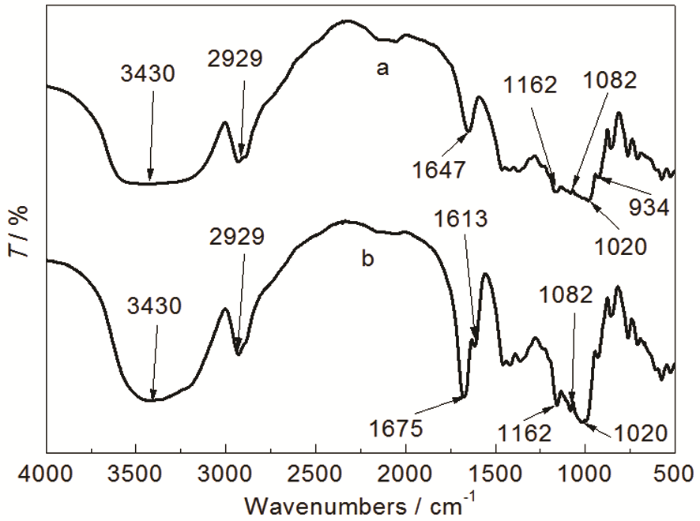
圖1 St-g-PAM的紅外譜圖
2.2 失重法
在20~50 ℃下,對Zn片在含不同質量濃度St-g-PAM的1.0 mol/L HCl溶液中進行失重實驗,得到鋅片的腐蝕速率值以及緩蝕率與不同質量濃度St-g-PAM關系曲線,如表1和圖2所示。可知,添加緩蝕劑能有效減緩Zn的腐蝕。在不同溫度下,隨著St-g-PAM含量的增加,鋅片的緩蝕率不斷增加。這是由于St-g-PAM吸附在Zn表面形成了保護層,減小了鋅片與腐蝕介質的接觸,從而減緩腐蝕速率。當St-g-PAM質量濃度為50 mg/L時,緩蝕率較高。但濃度超過50 mg/L后,緩蝕劑在鋅片表面的吸附基本達到飽和狀態,之后不會再受濃度的影響。在濃度一定時,隨著腐蝕介質溫度的升高,吸附在鋅片上的St-g-PAM分子會發生脫附,緩蝕率逐漸下降[12]。
表1 不同溫度下鋅片在不同質量濃度St-g-PAM的1.0 mol/L HCl溶液中的腐蝕速率
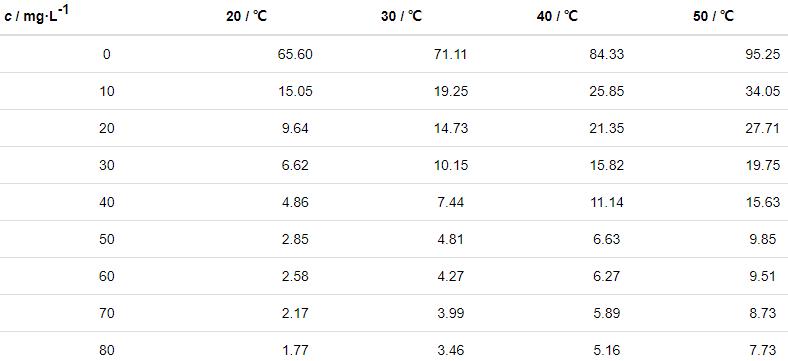
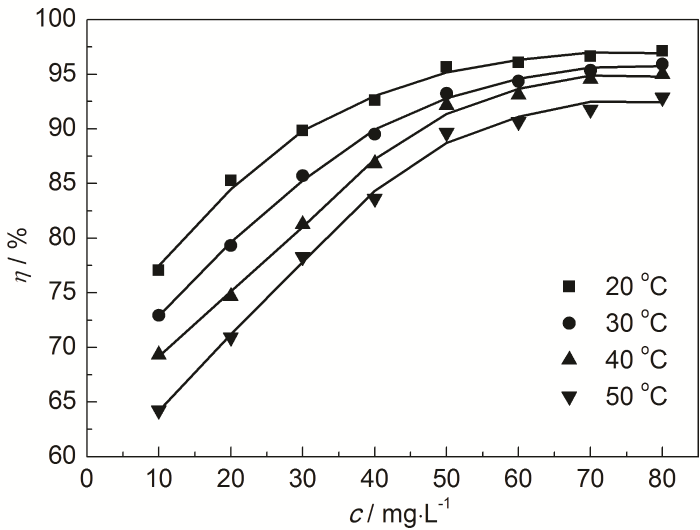
圖2 不同溫度下緩蝕率與緩蝕劑St-g-PAM質量濃度的關系曲線
2.3 動電位極化曲線
由圖3測得的極化曲線可以看出,添加St-g-PAM緩蝕劑后陰陽兩極電流密度明顯減小,說明緩蝕劑對陰陽兩極均產生了抑制作用。通過Tafel直線外推法測定極化曲線參數[13],按下式計算緩蝕率,結果列于表2。
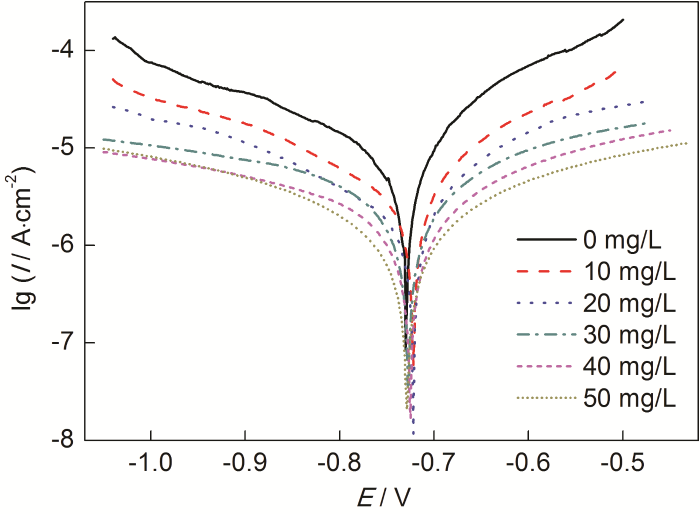
圖3 Zn在含不同質量濃度St-g-PAM的1.0 mol/L HCl溶液中的極化曲線
式中,I0corr和Icorr分別為空白溶液和加緩蝕劑后的腐蝕電流密度。
表2 Zn在不同質量濃度St-g-PAM條件下的極化曲線參數
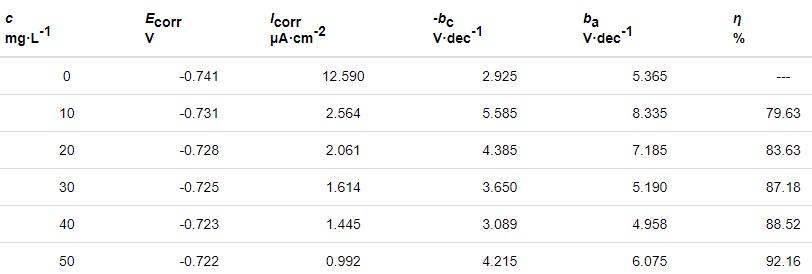
從表2可知,加入St-g-PAM后,腐蝕電位Ecorr略微向正方向移動,但移動值小于85 mV,說明St-g-PAM是混合型抑制劑,緩蝕作用機理為“幾何覆蓋效應”[14]。Icorr是評價電極體系腐蝕快慢的重要參數[15]。Icorr隨St-g-PAM質量濃度的增加而不斷下降,說明Zn的腐蝕程度不斷降低。當St-g-PAM質量濃度為50 mg/L時,η為92.16%,說明緩蝕劑對Zn在HCl溶液中的腐蝕具有良好的緩蝕作用。加入St-g-PAM后,陰陽極Tafel斜率bc和ba均發生變化,這是因為St-g-PAM吸附覆蓋了Zn表面的有效反應面積,使Zn-HCl溶液界面發生改變。此外,通過改變St-g-PAM質量濃度,Tafel曲線的斜率未見規律性的變化,說明緩蝕劑對H的析出和Zn的溶解都沒有影響,即緩蝕劑不影響Zn的溶解機制[16]。
2.4 電化學阻抗
由圖4測得的Nyquist圖可知,加入不同質量濃度的St-g-PAM后,阻抗譜形狀相似,說明體系的腐蝕電化學原理未發生改變。阻抗譜呈現單一半圓容抗弧,表明體系中金屬表面和緩蝕劑分子之間形成的電荷轉移吸附物發生在電極/溶液界面,且電荷轉移過程控制腐蝕反應[17],反映出電荷轉移電阻Rt和雙電層電容Cdl組成的阻容弛豫過程[18]。加入緩蝕劑后,容抗弧的直徑顯著變大。另外,St-g-PAM分子在電極表面吸附、脫附使電極表面變粗糙,體系產生頻率彌散效應,因此容抗弧并不顯示完整的半圓[19]。
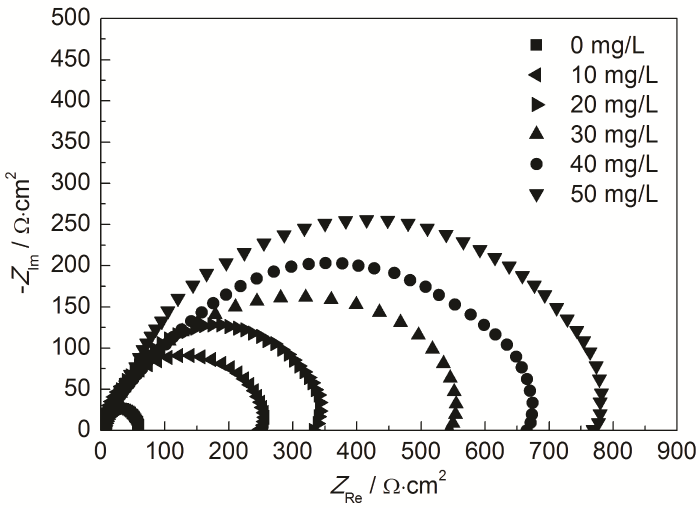
圖4 Zn在含不同質量濃度St-g-PAM的1.0 mol/L HCl溶液中的Nyquist圖
采用圖5所示的等效電路圖對數據進行擬合,其中Rs為溶液電阻 (Ω·cm2),Rct為電荷轉移電阻,CPE為常相位角元件。CPE由組分Qdl和系數a組成,該系數用來表述不同的物理現象,如表面粗糙度、緩蝕劑吸附、多孔層形成等導致表面不均勻性;當電極表面均勻且呈平面時,a等于1,則電極表面為理想雙電層電容。Qdl和Cdl關系式如下[17]:
![]()
式中,fmax表示虛值在Nyqutist圖上達到最大值的頻率,Hz;Qdl為常相位角元件參數,μΩ-1·sa·cm-2;a為彌散效應系數。各等效電路圖的元件參數及η值列于表3。緩蝕效率根據下式計算:
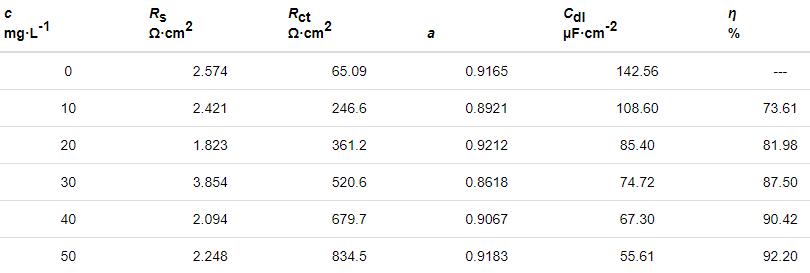
表3 Zn在不同質量濃度St-g-PAM下的阻抗參數
![]()
由表3可見,加入緩蝕劑后,Rt明顯增大,而Cdl不斷減小,這是由于St-g-PAM取代了原本吸附在Zn表面的水分子,介電常數變小或雙電層厚度增加[20]。當St-g-PAM質量濃度為50 mg/L時,η達92.2%,說明St-g-PAM緩蝕劑能有效抑制Zn的腐蝕。緩蝕率隨濃度的變化規律與極化曲線測得的結果相同。
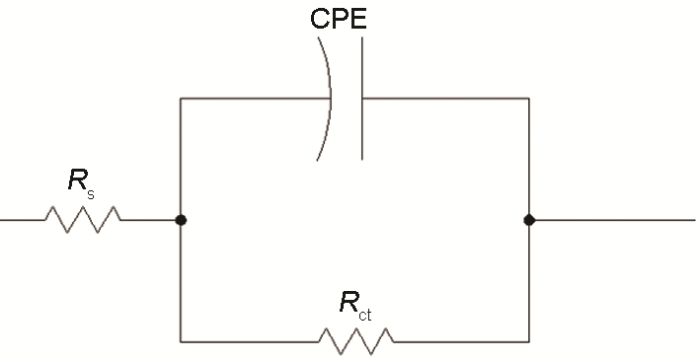
圖5 擬合電化學阻抗譜的等效電路圖
2.5 吸附等溫式
根據失重和電化學實驗結果,探究St-g-PAM分子在Zn表面的吸附作用。假設緩蝕劑作用于Zn表面符合Langmuir吸附等溫式,按下式進行數據擬合[4]:
![]()
式中,c為緩蝕劑質量濃度;θ為表面覆蓋度,近似等于緩蝕率;K為吸附平衡常數L/mg。
對20~50 ℃下失重數據和20 ℃下電化學數據的c/θ-c作圖 (圖6),得吸附等溫線,其參數見表4。

圖6 St-g-PAM在Zn表面的Langmuir吸附等溫線
表4 c/θ-c直線回歸參數表
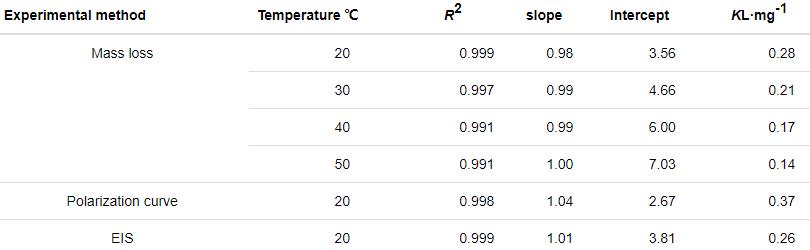
由表4可知,c/θ-c關系曲線的R2和直線斜率均接近1,表明St-g-PAM對鋅片的緩蝕作用與Langmuir吸附模型一致。失重實驗中吸附平衡常數K隨溫度的升高而降低,這是由于溫度升高,緩蝕體系中分子碰撞加快,Zn表面的腐蝕也顯著增加,Zn表面吸附的分子/離子的相互作用力變大,因此St-g-PAM緩蝕劑分子較難吸附在Zn表面[11]。
2.6 吸附熱力學
Zn表面吸附的熱力學參數,標準吸附焓 (ΔH0) 可依據Van't Hoff方程計算[21]:
![]()
式中,R為標準氣體常數;T為熱力學溫度,K;B為不定積分常數。對lnK-1/T進行直線擬合,見圖7,R2為0.9889,說明lnK與1/T之間具有線性關系,根據直線斜率求出ΔH0。
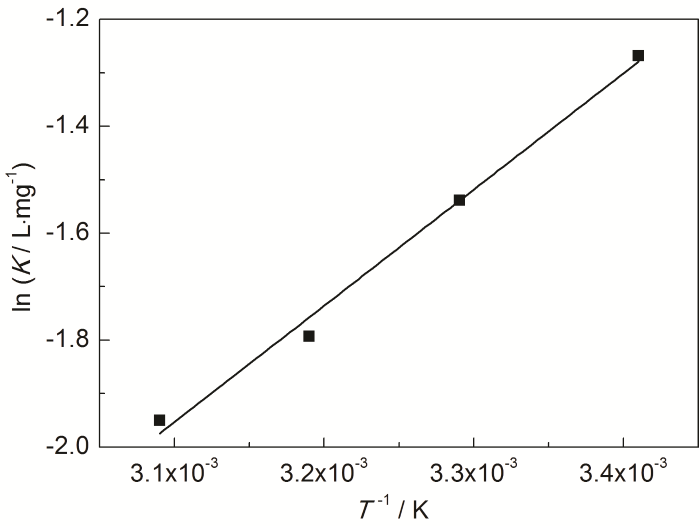
圖7 St-g-PAM在Zn表面吸附的lnK-1/T的關系曲線
標準吸附Gibbs自由能ΔG0與K之間存在如下關系式[22]:
![]()
式中,cH2O為溶劑水的質量濃度,近似值為1×106 mg/L;ΔG0為標準吸附Gibbs自由能,kJ/mol。
通過下面的熱力學公式求得標準吸附熵ΔS0,吸附熱力學參數見表5。
![]()
表5 St-g-PAM在Zn表面的吸附熱力學參數
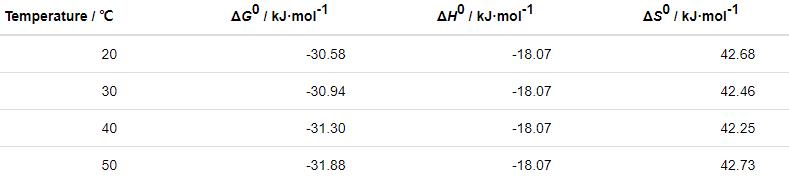
由以上計算可知,ΔH0<0,說明St-g-PAM在Zn表面的吸附過程是放熱過程,隨溫度升高,緩蝕劑分子吸附程度減弱,緩蝕性能降低。ΔG0<0,且在-40~-20 kJ/mol,說明緩蝕劑在Zn表面是由物理-化學作用下自發進行吸附的[12]。ΔS0>0,說明St-g-PAM分子在Zn表面的驅動取代了水分子。由于水分子脫附會引起混亂程度劇增,其遠大于St-g-PAM分子吸附在Zn表面引起的混亂程度的減小,因此體系的混亂程度相對增大[23]。
2.7 腐蝕動力學
在293~332 K的溫度范圍內,探究溫度對Zn腐蝕的影響,得到含不同濃度緩蝕劑的活化能、活化焓、活化熵等參數。
活化能與金屬腐蝕反應的快慢有關,根據Arrhenius方程[24]:
![]()
式中,ν為失重實驗的腐蝕速率;Ea為表觀活化能;A為指前因子。以lnν對1/T作圖,見圖8。可以看出,lnν與1/T具有良好的線性關系。根據直線的斜率可計算出Ea,如表6。
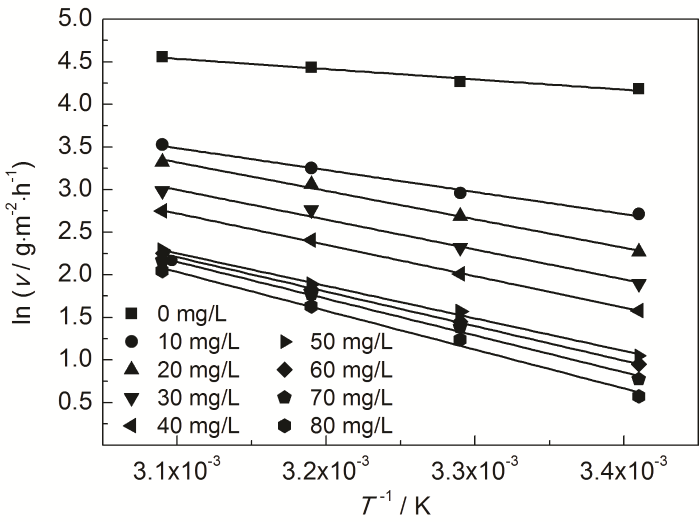
圖8 St-g-PAM在Zn表面吸附的lnν與1/T的關系曲線
表6 由lnν-1/T關系曲線擬合得到的腐蝕動力學參數
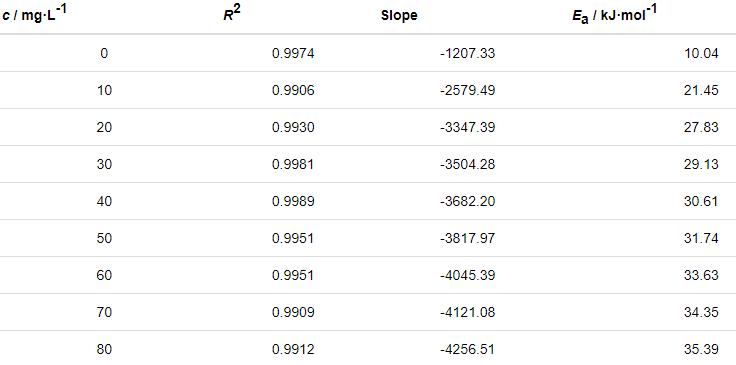
根據過渡態理論的關系式[25]:
![]()
式中,NA為Avogadro常數 (6.02×1023 mol),h為Plank常數 (6.626×10-34 J·s),ΔH≠是活化焓,ΔS≠是活化熵。作ln (ν/T)-1/T直線,見圖9。根據直線斜率和截距求出ΔH≠和ΔS≠,所求得的動力學參數列于表7。
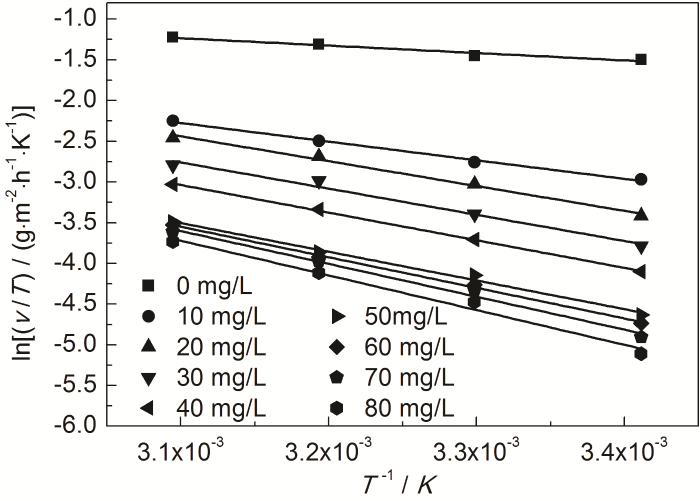
圖9 St-g-PAM在Zn表面吸附的 ln (ν/T) 與1/T的關系曲線
表7 由ln (ν/T)-1/T直線擬合得到的腐蝕動力學參數
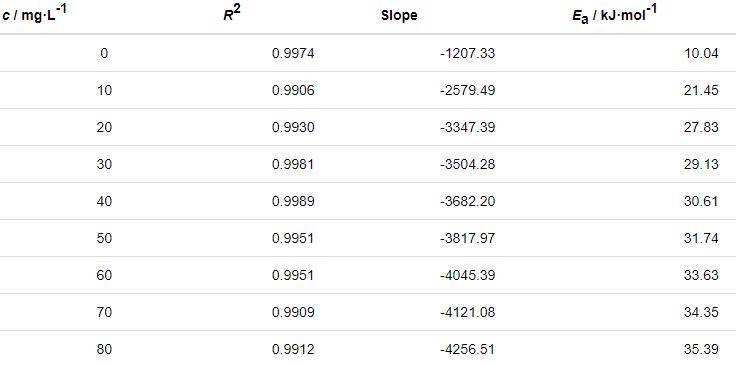
由表6可知,添加St-g-PAM體系的Ea高于空白溶液的,說明隨著溫度的升高,緩蝕劑的吸附過程減緩,緩蝕作用降低。隨著St-g-PAM含量的增加,活化能增加,由于加入緩蝕劑后,緩蝕劑分子覆蓋在Zn表面,使Zn發生腐蝕反應的活性位點減少,Zn發生腐蝕反應所需要的能量變高,腐蝕反應變慢[11]。由表7可知,ΔH≠>0,說明鋅片溶解是吸熱過程。ΔS≠<0,說明速率控制步驟是將反應物轉變為活化絡合物的締結過程,而非離解過程,同時表明反應物到活化絡合物的無序度降低。加入緩蝕劑后,ΔS≠逐漸變大,說明腐蝕反應越來越難進行[18]。
2.8 表面形貌分析
圖10為鋅片在20 ℃下1.0 mol/L HCl溶液中浸泡2 h后的SEM和AFM像。如圖10a和b所示,鋅片在未加緩蝕劑時腐蝕嚴重,并生成腐蝕產物,表面粗糙,凹凸不平。而在添加緩蝕劑后 (圖10c),鋅片腐蝕程度明顯較輕,表面甚至顯示出打磨的痕跡,幾乎無“溝壑”;圖10d亦表明,Zn腐蝕表面仍然相對平整和均勻。添加緩蝕劑后,表面粗糙度從40.16 nm降到12.41 nm,說明St-g-PAM有效抑制了鋅片在鹽酸介質中的腐蝕。

圖10 Zn在20 ℃下1.0 mol/L HCl溶液中浸泡2 h的SEM和AFM像
2.9 緩蝕機理
根據上述實驗與分析,得出淀粉接枝共聚物的緩蝕作用機理為:Zn在腐蝕過程中,會吸附HCl溶液中的Cl-,使Zn表面產生負電荷,而St-g-PAM分子中含較多的N、O原子,易在酸溶液中被H+質子化,因此質子化的St-g-PAM由于靜電引力吸附在帶負電的Zn表面,形成一層均勻的吸附層[26];St-g-PAM中的N、O原子的孤對電子與Zn的空d軌道形成配位鍵,產生化學吸附,生成配位化合物,整齊排列到金屬表面。由于物理和化學吸附兩種作用力共同作用,St-g-PAM在Zn表面產生良好的緩蝕效果。
3 結論
(1) 添加淀粉接枝共聚物St-g-PAM后,Zn在HCl溶液中的腐蝕受到顯著抑制。隨著St-g-PAM添加量增加,緩蝕率不斷增大,而溫度升高,緩蝕效果降低。St-g-PAM在鋅片的吸附過程與Langmuir吸附模型一致。
(2) St-g-PAM在Zn表面的吸附過程是放熱過程,其通過物理和化學方式自發吸附在Zn表面抑制其腐蝕。
(3) 隨著St-g-PAM添加量的增加,Zn腐蝕電流密度減小,電荷轉移電阻增大,說明St-g-PAM對Zn在HCl溶液中具有良好的緩蝕性能,并且是一種混合抑制型緩蝕劑。
參考文獻
[1]Abdallah M, Ahmed S A, Altass H M, et al.
Competent inhibitor for the corrosion of zinc in hydrochloric acid based on 2,6-bis-[1-(2-phenylhydrazono) ethyl] pyridine
[J]. Chem. Eng. Commun., 2019, 206: 137
[本文引用: 1]
[2]Ren T G, Su H S, Liu Y, et al.
Research progress of metal corrosion inhibitors
[J]. Chem. Res., 2018, 29: 331
[本文引用: 1]
任鐵鋼, 蘇慧雙, 劉月等.
金屬緩蝕劑的研究進展
[J]. 化學研究, 2018, 29: 331
[本文引用: 1]
[3]Shi H, Shi J, Tang J J, et al.
Corrosion inhibition of cetyltrimethyl ammonium bromide for zinc in hydrochloric acid solution
[J]. Clean. World, 2012, 28(10): 22
[本文引用: 1]
史慧, 史靜, 唐俊杰等.
十六烷基三甲基溴化銨在鹽酸介質中對鋅的緩蝕作用
[J]. 清洗世界, 2012, 28(10): 22
[本文引用: 1]
[4]Wang X, Ren S F, Jiang H, et al.
Preparation method and research direction of plant corrosion inhibitors
[J]. Surf. Technol., 2018, 47(3): 196
[本文引用: 2]
王霞, 任帥飛, 蔣歡等.
植物緩蝕劑的制備方法與研究方向
[J]. 表面技術, 2018, 47(3): 196
[本文引用: 2]
[5]Abiola O K, James A O.
The effects of Aloe vera extract on corrosion and kinetics of corrosion process of zinc in HCl solution
[J]. Corros. Sci., 2010, 52: 661
[本文引用: 1]
[6]Liang M, Zhou H B, Huang Q M, et al.
Synergistic effect of polyethylene glycol 600 and polysorbate 20 on corrosion inhibition of zinc anode in alkaline batteries
[J]. J. Appl. Electrochem., 2011, 41: 991
[本文引用: 1]
[7]Deyab M A.
Hydroxyethyl cellulose as efficient organic inhibitor of zinc-carbon battery corrosion in ammonium chloride solution: Electrochemical and surface morphology studies
[J]. J. Power Sources, 2015, 280: 190
[本文引用: 1]
[8]Du Q, Wei H, Li A M, et al.
Evaluation of the starch-based flocculants on flocculation of hairwork wastewater
[J]. Sci. Total Environ., 2017, 601/602: 1628
[本文引用: 1]
[9]Fu H, Li X H, Li Y X, et al.
Corrosion inhibition of cassava starch graft acryl amide copolymer for cold rolled steel in hydrochloric acid
[J]. J. Chin. Soc. Corros. Prot., 2011, 31: 265
[本文引用: 1]
付惠, 李向紅, 李云仙等.
木薯淀粉接枝共聚物在鹽酸介質中對冷軋鋼的緩蝕作用
[J]. 中國腐蝕與防護學報, 2011, 31: 265
[本文引用: 1]
[10]Li X H, Fu H, Li Y X, et al.
Corrosion inhibition of cassava starch graft copolymer for Al in HCl solution
[J]. Corros. Sci. Prot. Technol., 2016, 28: 525
[本文引用: 2]
李向紅, 付惠, 李云仙等.
木薯淀粉接枝共聚物在HCl溶液中對Al的緩蝕性能研究
[J]. 腐蝕科學與防護技術, 2016, 28: 525
[本文引用: 2]
[11]Li X H, Deng S D, Lin T, et al.
Cassava starch-sodium allylsulfonate-acryl amide graft copolymer as an effective inhibitor of aluminum corrosion in HCl solution
[J]. J. Taiwan Inst. Chem. Eng., 2018, 86: 252
[本文引用: 3]
[12]Liu J, Zhao D S, Li J J, et al.
Inhibition performance of Gemini surfactant for znic in acid medium
[J]. Corros. Prot., 2016, 37: 983
[本文引用: 2]
劉靜, 趙地順, 李靜靜等.
酸性溶液中雙子表面活性劑對金屬鋅的緩蝕性能
[J]. 腐蝕與防護, 2016, 37: 983
[本文引用: 2]
[13]Jia Z, Dai C S, Chen L. Electrochemical Measurement Method [M]. Beijing: Chemical Industry Press, 2006
[本文引用: 1]
賈錚, 戴長松, 陳玲. 電化學測量方法 [M]. 北京: 化學工業出版社, 2006
[本文引用: 1]
[14]Cao C.
On electrochemical techniques for interface inhibitor research
[J]. Corros. Sci., 1996, 38: 2073
[本文引用: 1]
[15]Cao C N. Principles of Electrochemistry of Corrosion [M]. 3rd Ed., Beijing: Chemistry Industry Press, 2008
[本文引用: 1]
曹楚南. 腐蝕電化學原理 [M]. 第三版. 北京: 化學工業出版社, 2008
[本文引用: 1]
[16]Negm N A, Al Sabagh A M, Migahed M A, et al.
Effectiveness of some diquaternary ammonium surfactants as corrosion inhibitors for carbon steel in 0.5 M HCl solution
[J]. Corros. Sci., 2010, 52: 2122
[本文引用: 1]
[17]Negm N A, Kandile N G, Badr E A, et al.
Gravimetric and electrochemical evaluation of environmentally friendly nonionic corrosion inhibitors for carbon steel in 1 M HCl
[J]. Corros. Sci., 2012, 65: 94
[本文引用: 2]
[18]Poornima T, Nayak J, Shetty A N.
Effect of 4- (N,N-diethylamino) benzaldehyde thiosemicarbazone on the corrosion of aged 18 Ni 250 grade maraging steel in phosphoric acid solution
[J]. Corros. Sci., 2011, 53: 3688
[本文引用: 2]
[19]Lebrini M, Lagrenée M, Vezin H, et al.
Experimental and theoretical study for corrosion inhibition of mild steel in normal hydrochloric acid solution by some new macrocyclic polyether compounds
[J]. Corros. Sci., 2007, 49: 2254
[本文引用: 1]
[20]Hanza A P, Naderi R, Kowsari E, et al.
Corrosion behavior of mild steel in H2SO4 solution with 1,4-di [1′-methylene-3′-methyl imidazolium bromide]-benzene as an ionic liquid
[J]. Corros. Sci., 2016, 107: 96
[本文引用: 1]
[21]Musa A Y, Kadhum A A H, Mohamad A B, et al.
On the inhibition of mild steel corrosion by 4-amino-5-phenyl-4H-1, 2, 4-trizole-3-thiol
[J]. Corros. Sci., 2010, 52: 526
[本文引用: 1]
[22]Qiang Y J, Zhang S T, Guo L, et al.
Sodium dodecyl benzene sulfonate as a sustainable inhibitor for zinc corrosion in 26%NH4Cl solution
[J]. J. Clean. Prod., 2017, 152: 17
[本文引用: 1]
[23]Wang X M, Yang H Y, Wang F H.
A cationic gemini-surfactant as effective inhibitor for mild steel in HCl solutions
[J]. Corros. Sci., 2010, 52: 1268
[本文引用: 1]
[24]Hegazy M A, El-Tabei A S, Bedair A H, et al.
An investigation of three novel nonionic surfactants as corrosion inhibitor for carbon steel in 0.5 M H2SO4
[J]. Corros. Sci., 2012, 54: 219
[本文引用: 1]
[25]Ali S M, Al Lehaibi H A.
Control of zinc corrosion in acidic media: Green fenugreek inhibitor
[J]. Trans. Nonferrous Met. Soc. China, 2016, 26: 3034
[本文引用: 1]
[26]Satapathy A K, Gunasekaran G, Sahoo S C, et al.
Corrosion inhibition by Justicia gendarussa plant extract in hydrochloric acid solution
[J]. Corros. Sci., 2009, 51: 2848
[本文引用: 1]
免責聲明:本網站所轉載的文字、圖片與視頻資料版權歸原創作者所有,如果涉及侵權,請第一時間聯系本網刪除。

官方微信
《中國腐蝕與防護網電子期刊》征訂啟事
- 投稿聯系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 中國腐蝕與防護網官方QQ群:140808414





