近年來,隨著能源需求的不斷增長,天然氣作為一種高效、優質的清潔能源,在化石能源中的使用占比越來越高。世界各國也加大了天然氣的勘探和開發力度[1]。在部分氣田的開發過程中,H2S、CO2 等氣體往往隨著甲烷等碳氫化合物從地層經過油管進入地面管線或設備,造成井下管柱、地面管線和設備的嚴重腐蝕[2]。特別是在高含硫氣田的開發過程中,油管中還可能存在S 沉積[3],導致油管堵塞和嚴重的局部腐蝕[4]。
S腐蝕的機理十分復雜。根據目前的研究報道,可能的腐蝕機理有:催化機理[5]、水解反應機理[6]、電化學腐蝕機理[7]、多硫化物腐蝕機理[8]、直接腐蝕機理[9]以及S 的氫脆及應力腐蝕機理[10]。S 腐蝕具有破壞性強、發展迅速和防護難度高等特點,已經成為含硫氣田生產安全的重要挑戰之一。在高含H2S 氣井中,為了防止H2S 腐蝕和硫化物應力腐蝕開裂,通常選用抗硫碳鋼作為油套管材質[11]。然而,H2S 和S 往往同時存在,可能導致抗硫碳鋼發生S 腐蝕[12],但相關標準并沒有闡明抗硫碳鋼在S 環境中的適用性[13]。在天然氣開采過程中,油管的S 腐蝕可能受到溫度和濕度的影響,但截止目前,相關的研究尚未見報道。因此,開展抗硫碳鋼的S 腐蝕行為研究,明確不同溫度和濕度條件下S 腐蝕的特征和腐蝕機理,對保障含硫天然氣的開采安全具有重要意義。
在較低的溫度下,干燥的環境中S 不會對碳鋼造成腐蝕,因此,環境的相對濕度是開展S 腐蝕相關研究應該考慮的一個重要因素。目前,較多學者將試樣完全浸沒在含S 的腐蝕液中進行腐蝕評價和腐蝕機理研究,這與現場工況環境存在一定的差異,不能體現濕度對S 腐蝕的影響。因此,為了明確抗硫碳鋼在不同溫度和濕度條件下的S 腐蝕特征和腐蝕機理,本文開展了P110SS 特種抗硫鋼在不同濕度和溫度條件下的S 腐蝕實驗。采用X 射線光電子能譜(XPS)和掃描電子顯微鏡(SEM)等分析了P110SS 鋼的S 腐蝕產物組成、腐蝕產物形貌及厚度、腐蝕產物截面形貌以及去膜后樣品表面微觀形貌。最后,分析了不同溫度和濕度條件下,抗硫鋼的S 腐蝕機理。研究結果能夠為S 腐蝕控制提供參考。
1 實驗方法
實驗所用材料為P110SS 特種抗硫鋼,其化學成分(質量分數,wt.%)為:C 0.20,Cr 1.06,Mo 0.89,Mn 0.45,Si 0.23,V 0.07,Fe 余量。實驗中,采用了兩種規格的長方體試樣:30mm×15mm×3mm 和10mm×10mm×1.5mm。第一種試樣用作表面腐蝕產物微觀形貌觀察和去膜后基體腐蝕形貌觀察,第二種試樣用作腐蝕截面微觀形貌觀察和XPS 分析。圖1 為P110SS 鋼的金相組織圖。由圖可知,P110SS 鋼主要由回火索氏體組成。元素硫選用升華硫粉,分子式為S8。
圖2 為實驗裝置示意圖,整個裝置由廣口瓶、反應燒杯、溫濕度傳感器、加熱裝置和玻璃支架組成。P110SS 試片放置于反應燒杯內的玻璃支架上,廣口瓶盛放純水,使用溫濕度傳感器(VMS-3002-WS)來監測反應燒杯內的相對濕度和溫度。實驗過程中,反應燒杯內的相對濕度控制方法如下:向除氧的純水中通入干燥的CO2,通過控制CO2 流量以及純水的溫度來控制反應燒杯內相對濕度(氣體流量采用玻璃轉子流量計測量;加熱裝置w 選用SZCL 型加熱套)。表1 為不同溫度下測得的反應燒杯內的相對濕度。反應溫度通過X1010T 型恒溫加熱臺調控,反應燒杯外加保溫層。

圖1 P110SS 鋼的金相組織
表1 反應瓶內的相對濕度
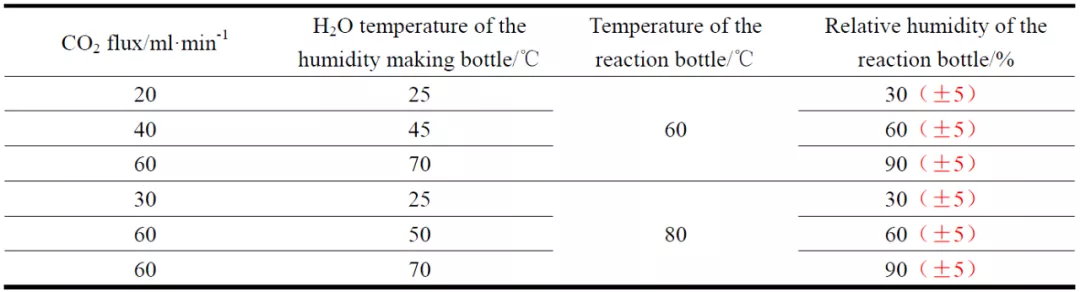
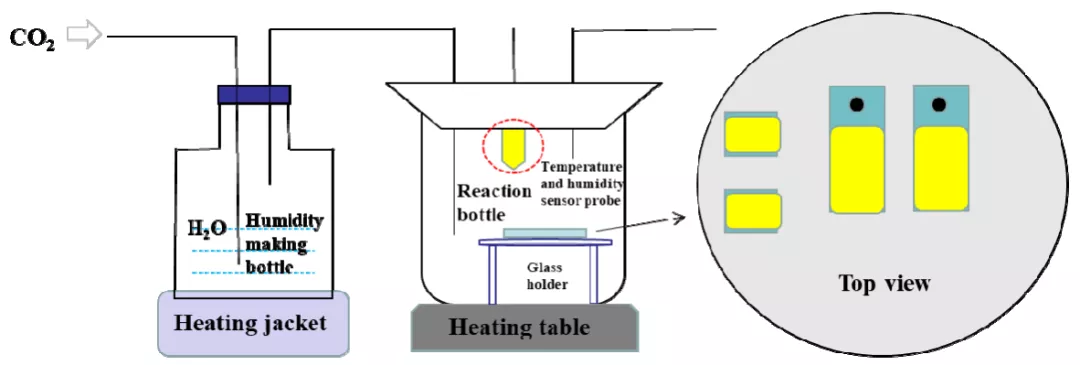
圖2 實驗裝置示意圖
采用400、1500 目的砂紙逐級打磨試樣表面,用乙醇和丙酮清洗試片后,用N2 將試片吹干。每組實驗用兩種尺寸的試片各兩片。將S 和NaCl 按照質量比2:1 的比例混合,攪拌均勻后覆蓋在試片表面,然后放入反應瓶中。實驗開始前,濕氣瓶通2h CO2,反應瓶通2h N2 來除去實驗裝置中的O2,除氧后,按圖2 所示連接實驗裝置。反應瓶溫度控制在60℃和80℃;相對濕度調節為30%、60%和90%,實驗時間為120h。實驗結束后,取出試片,并用N2 吹干。尺寸為10mm×10mm×1.5mm 的試樣,其一密封保存待XPS檢測,另一試樣用環氧樹脂封住,將側面拋光用于截面微觀形貌觀察;尺寸為30mm×15mm×3mm 的試樣,其一密封保存以用于腐蝕產物微觀形貌觀察,另一試樣用去膜液去除表面腐蝕產物,并用酒精清洗,N2 吹干,用于去膜后基體腐蝕微觀形貌觀察。去膜液由10g 六次甲基四胺、100mL 濃鹽酸和900mL 純水配制。
采用VG Multilab 2000 型X 射線光電子能譜(XPS)儀測試腐蝕產物的化學組成。儀器真空腔基壓范圍為10-7~10-8Pa,以Al Ka 作為X 射線源(1486.6eV),光電子能譜通能為45eV、停留時間為50ms、步長為0.2eV,得到的數值通過C1s(284.6eV)矯正。利用XPSPEAK41 軟件對XPS 數據進行分峰擬合。采用ZEISS EV0 MA15 型掃描電子顯微鏡(SEM)觀察去除腐蝕產物膜前后試片的腐蝕形貌和腐蝕產物膜截面形貌。
2 結果與討論
2.1 腐蝕產物成分分析
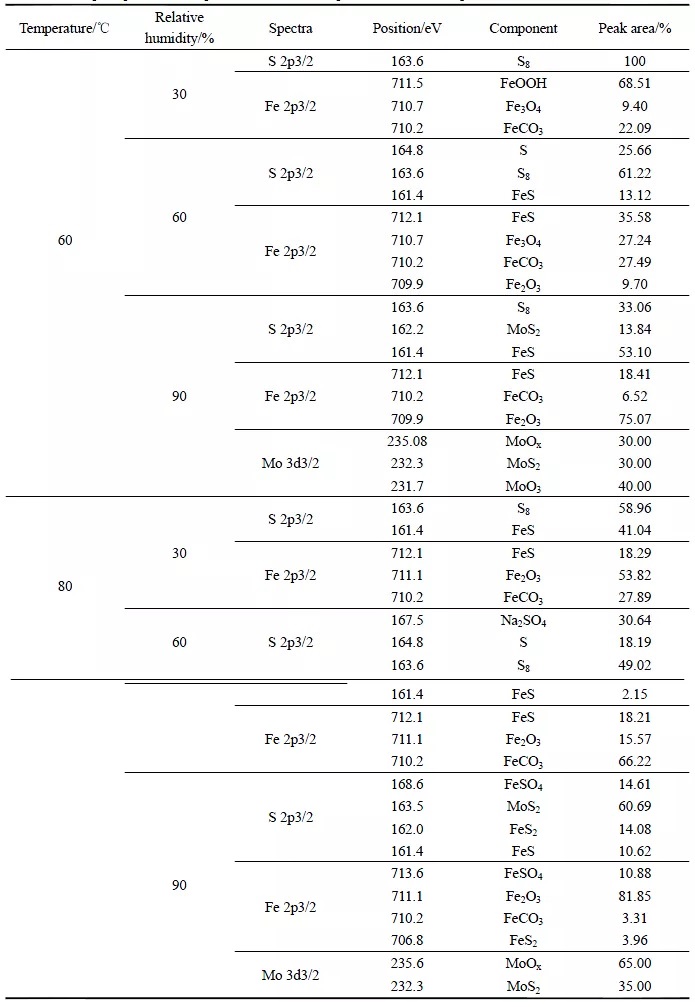
圖3 為60℃時不同相對濕度下S(2p3/2)、Fe(2p3/2)和Mo(3d3/2)的XPS 高分辨譜。S(2p3/2)的高分辨譜(圖3a)顯示,164.8eV、163.6eV、162.2eV 和161.4eV 處的峰分別對應于S(單質)[14]、S8(單質)[15]、MoS2[16]、FeS[17];Fe(2p3/2)的高分辨譜(圖3b)顯示,712.1eV、711.5eV、710.7eV、710.2eV和709.9eV 處的峰分別對應于FeS[17]、FeOOH[18]、Fe3O4[19]、FeCO3[20]和Fe2O3[21];Mo(3d3/2)的高分辨譜(圖3c)顯示,235.08eV、232.3eV 和231.7eV 處的峰分別對應于MoOx[22]、MoS2[23]和MoO3[24]。各物質的相對含量見表2。
由圖3a 和表2 可知,在溫度為60℃,相對濕度為30%的條件下,XPS 圖譜數據較為散亂、且信號較弱,腐蝕產物中S 含量較低,僅存在硫單質S8,無S 的其他化合物存在。這表明,S 在該條件下很可能未參與腐蝕反應,試樣的腐蝕主要是CO2 和Cl-造成的[25, 26]。當相對濕度增加到60%時,腐蝕產物中出現FeS,這表明S 已經參與了腐蝕反應。當相對濕度達到90%后,除了FeS 之外,還出現了少量Mo 的硫化物MoS2。Mo(3d3/2)的XPS 高分辨譜如圖3c 所示,Mo 本可以提升金屬耐腐蝕的能力,還能使金屬晶粒細化提高淬透性和熱強性[27],MoS2 的出現表明試片表面腐蝕程度增加。
從Fe(2p3/2)的高分辨圖譜(圖3b)可以看出,在溫度為60℃,相對濕度為30%的條件下未發現鐵硫化合物的存在,這與S(2p3/2)的XPS 高分辨譜顯示的結果是一致的。在相對濕度為60%和90%的條件下均出現了腐蝕產物FeS。同時,60℃不同濕度條件下均有FeCO3,這表明在不同濕度條件下,CO2 均參與了腐蝕反應。
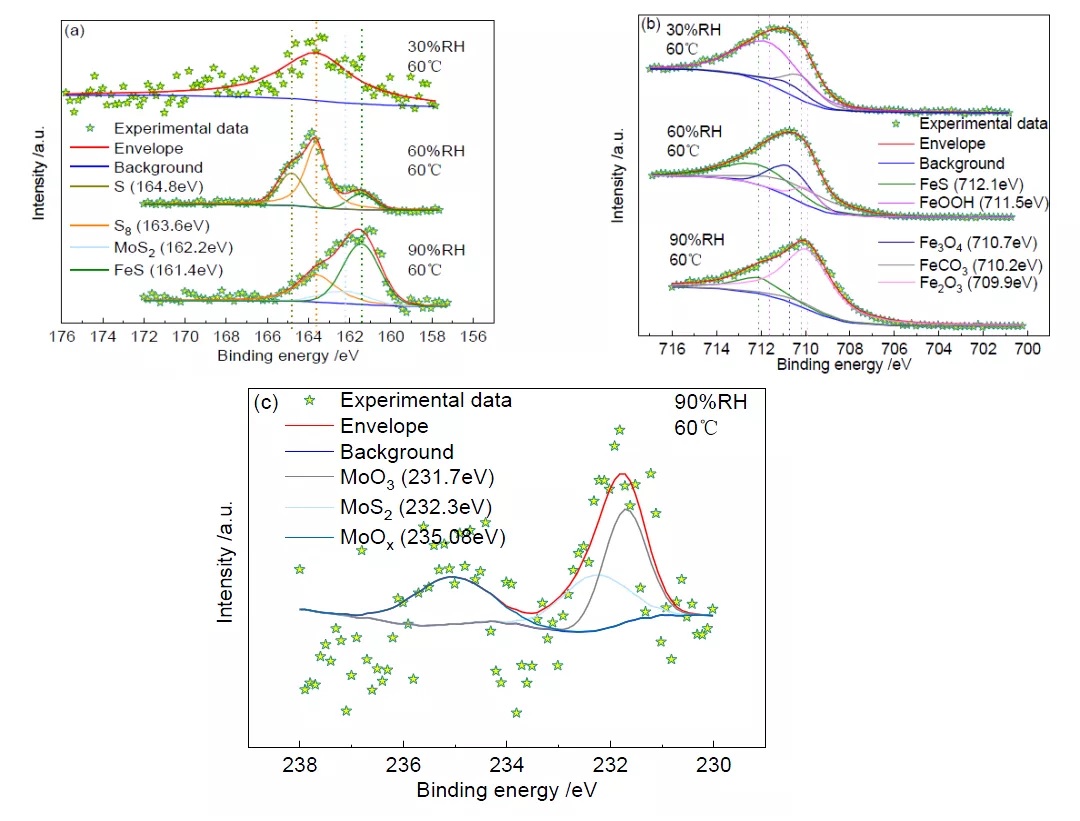
圖3 60℃、不同相對濕度下S(2p3/2)、Fe(2p3/2)和Mo(3d3/2)的XPS 高分辨譜
圖4 為80℃時不同相對濕度下S(2p3/2)、Fe(2p3/2)和Mo(3d3/2)的XPS 高分辨譜。S(2p3/2)的高分辨譜(圖4a)顯示,168.6eV、167.5eV、164.8eV、163.6eV、163.5eV、162.0eV 和161.4eV 處的峰分別對應于FeSO4[28]、Na2SO4[29]、S(單質)、S8(單質)、MoS2[30]、FeS2[31]和FeS;Fe(2p3/2)的高分辨譜(圖4b)顯示,713.6eV、712.1eV、711.1eV、710.2eV 和706.8eV 處的峰分別對應于FeSO4[32]、FeS、Fe2O3[33]、FeCO3 和FeS2[17];Mo(3d3/2)的高分辨譜(圖4c)顯示,235.6eV 和232.3eV 處的峰分別對應于MoOx[22]和MoS2[23]。各物質的相對含量見表2。
由圖4a 和表2 可知,溫度為80℃時,即使在相對濕度為30%的條件下,仍發現了腐蝕產物FeS。這說明了溫度升高后,即便是在30%的濕度下,S 仍然能夠參與腐蝕反應。當相對濕度達到60%時,腐蝕產物中除了FeS 外,還出現了硫酸鹽,硫酸鹽的出現證實了S 在此溫濕條件下發生了水解反應,方程式為:
S8 + 8H2O → 6H2S + 2H2SO4 (1)
當相對濕度增加到90%后,腐蝕產物中出現了FeSO4、FeS2 和MoS2。FeSO4 的存在證實S 水解反應的確存在,濕度升高后,生成了更多的酸,導致試片發生了酸腐蝕。同時,腐蝕產物中有MoS2 存在,Mo(3d)的高分辨圖譜如圖4c 所示。
由Fe(2p3/2)的XPS 擬合結果(圖4b)可知,在不同的濕度條件下均存在FeCO3。在相對濕度為30%和60%條件下的腐蝕產物組成相同,均由FeS、Fe2O3 和FeCO3 組成。當相對濕度達到90%時,FeS 轉換成FeS2,S 水解反應加劇,生成了較多H2SO4,導致腐蝕產物中出現了FeSO4。
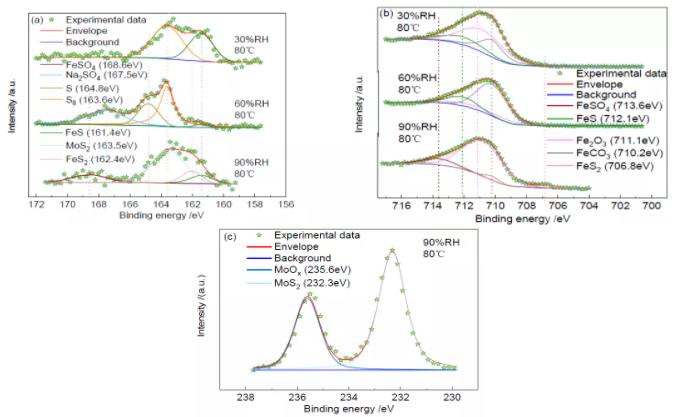
圖4 80℃、不同相對濕度下S(2p3/2)、Fe(2p3/2)和Mo(3d3/2)的XPS 高分辨譜
表2 不同溫濕度下各物質峰面積比
根據XPS 結果分析可知,P110SS 鋼的S 腐蝕特征和腐蝕機理隨溫度和濕度的變化而改變。在溫度為60℃、相對濕度為30%的條件下,S 不參與腐蝕反應;升溫或增加濕度會導致S 腐蝕發生。在溫度為60℃時,即使增加相對濕度,S 也不會發生水解反應;在80℃、相對濕度為60%及以上時,S 發生了水解反應。
2.2 表面及截面分析
2.2.1 腐蝕產物表面形貌
圖5 為不同溫濕度條件下P110SS 鋼表面腐蝕產物微觀形貌。在溫度為60℃時,不同相對濕度條件下的腐蝕產物膜差異明顯。在相對濕度為30%時(圖5a),腐蝕產物較少,腐蝕產物膜表面可見細小裂縫;在相對濕度為60%時(圖5b),腐蝕產物膜出現龜裂現象,無裂縫處表面較為平整均勻;當相對濕度達到90%時(圖5c),腐蝕產物膜裂縫增多、變寬。
當溫度為80℃時,在相對濕度為30%的條件下(圖5d),腐蝕產物膜表面平整均勻,有較多細小裂縫;在相對濕度為60%時(圖5e),腐蝕產物膜出現裂縫,表面凹凸不平;當相對濕度達到90%時(圖5f),腐蝕產物膜質地疏松且易脫落。
由腐蝕產物微觀形貌分析可知:溫度主要影響腐蝕產物膜的致密度。當溫度為60℃時,產物膜裂縫呈迸裂狀;當溫度為80℃時,產物膜裂縫呈撕裂狀。有研究指出,這種腐蝕產物膜特征與溫度有關,即溫度升高,腐蝕產物膜致密度下降,產物膜表面裂縫的形貌發生顯著改變[34]。

圖5 不同溫濕度下覆蓋S 的P110SS 鋼表面腐蝕產物形貌
(b) 60%RH/60℃, (c) 90%RH/60℃, (d) 30%RH/80℃, (e) 60%RH/80℃ and (f) 90%RH/80℃
2.2.2 腐蝕產物膜截面分析
為進一步分析溫濕度對腐蝕產物膜厚度和微觀結構的影響,采用SEM 觀察了腐蝕截面的微觀形貌,見圖6。在溫度相同的條件下,腐蝕產物膜的厚度隨相對濕度的升高而增加;在濕度相同的條件下,腐蝕產物膜的致密度隨溫度的升高而下降。
當溫度為60℃時,在相對濕度為30%的條件下(圖6a),腐蝕產物膜層的厚度約為10μm;在相對濕度為60%的條件下(圖6b),腐蝕產物膜厚度約為17μm,膜層間孔隙較多;當相對濕度增加到90%時(圖6c),腐蝕產物膜厚度增加到30μm,膜層較為致密。
在溫度為80℃的條件下,當相對濕度為30%時(圖6d),腐蝕產物膜厚度約為7μm,且致密性較差;當相對濕度為60%時(圖6e),腐蝕產物膜增厚至23μm,膜層中出現較多裂縫;當相對濕度達到90%后(圖6f),腐蝕產物膜厚度達到44μm,膜層中有較多垂直于試片表面的細小裂縫,同時可見明顯點蝕坑剖面,點蝕深度約為12μm,點蝕坑直徑約為30μm。

圖6 不同溫濕度下覆蓋S 的P110SS 鋼腐蝕截面SEM 圖
2.2.3 去膜后試片腐蝕形貌
圖7 為不同溫濕度條件下P110SS 鋼表面去除腐蝕產物膜后的SEM ,圖8 為在30%RH/60℃條件下覆蓋物不含S 時的P110SS 鋼表面去除腐蝕產物膜后的SEM。當溫度為60℃時,在相對濕度為30%的條件下(圖7a),試片表面出現了點蝕坑,點蝕坑邊緣平滑,由前文XPS 分析結果可知,該條件下S并未參與試片的腐蝕反應,由圖8 可知,在不含S 的條件下,試片表面出現了明顯的點蝕坑,這表明試片的點蝕是由CO2 和Cl-造成的;在相對濕度為60%的條件下(圖7b),S 參與腐蝕反應,腐蝕主要表現為全面腐蝕的特征;當相對濕度達到90%時(圖7c),S 腐蝕加重,試片表面出現較多腐蝕裂縫,腐蝕仍表現為全面腐蝕的特征。
當溫度為80℃時,在相對濕度為30%的條件下(圖7d),試片表面出現較多點蝕坑,點蝕坑邊緣銳利,這表明,升高溫度可以提高S 和試片表面的活性,S 參與腐蝕反應導致了試片表面點蝕的發生;在相對濕度為60%的條件下(圖7e),試片的腐蝕表現出全面腐蝕的特征;在相對濕度達到90%時(圖7f),由于元素硫發生了水解反應,試片表面局部酸化,使得腐蝕表現出全面腐蝕并伴隨點蝕的特征。

圖7 不同溫濕度下覆蓋S 的P110SS 鋼表面去膜后形貌

圖8 30%RH/60℃條件下覆蓋物不含S 時的P110SS 鋼表面去膜后形貌
2.3 腐蝕機理分析
通過XPS 以及腐蝕產物微觀形貌分析,得到了P110SS 抗硫鋼在不同溫度和濕度條件下的S/CO2/Cl-體系中的腐蝕機理:
60℃時,在相對濕度為30%的條件下,S 未參與腐蝕反應,此溫濕度下S 性質穩定。試片表面的非金屬夾雜物在Cl-的作用下會形成局部腐蝕,由于閉塞電池的作用,坑外的Cl-向坑內遷移,而帶正電的坑內金屬離子向坑外遷移,從而產生明顯點蝕坑[26]。相對濕度達到60%及以上后,試片表面形成薄液膜,由CO2 水解產生的H+增多,S 可能在覆蓋的部位發生陰極反應生成了H2S,使得試片表面H2S 濃度很高[35],實驗尾氣有濃烈的臭雞蛋氣味可以證明H2S 的產生,H2S 溶于水逐步電離生成H+和S2-。H+作為強去極化劑加速了陰極反應,進而導致試片的腐蝕,并生成了腐蝕產物FeS,FeS 的自身結構缺陷使其具有半導體特性,進一步促進腐蝕的加重[5]。同時,Mo 的溶解極大地降低了試片的耐蝕性能[27],促進了腐蝕向更嚴重的趨勢發展。主要反應如下:
S+2H++2e-→H2S (2)
H2S→H++HS-→2H++S2- (3)
Fe→Fe2++2e- (4)
Mo→Mo4++4e- (5)
Fe2++S2-→FeS (6)
Mo4++2S2-→MoS2 (7)
當溫度升高到80℃時,S 的反應活性提高,在相對濕度為30%的條件下也可能按照上述方程式反應生成FeS。當相對濕度增大到60%及以上時,水電離生成更多的H+吸附于S 表面,改變了S 的極性與分子結構,進一步地增加了其活性,導致了S 水解反應的發生,化學反應式為[36]:
(x+y+1)S+yH2O→(y+1)HS-+SxOy2-+(y-1)H+ (8)
其中,氧化態產物SxOy2-可以為S2O32-、SO32-、SO42-和SxO62-中的一種或幾種。隨著反應的進行,HS-和S2-濃度進一步提高,硫化物逐漸積累,當生成的硫化物膜不能夠有效地阻止腐蝕性陰離子向腐蝕產生的坑內遷移的時候,腐蝕造成的缺陷處將會形成閉塞的腐蝕電池,從而導致點蝕的加重。FeS 還會催化S 的水解生成更多的SO42-和S2-,同時,其在80℃、90%RH 的條件下易失去一個電子生成[FeS]+,[FeS]+會與S2-和H+反應生成具有半導體特性的FeS2,其附著力差,易脫落,也會導致局部腐蝕的發生[37],化學反應方程式為:
FeS-e-→[FeS]+ (9)
2[FeS]++2S2-+2H+→2FeS2+H2 (10)
3 結論
(1)在不同的溫度和濕度條件下,P110SS 鋼的S 腐蝕特征不同。在溫度為60℃時,S 的腐蝕主要以全面腐蝕為主。當溫度為80℃時,在相對濕度為30%的條件下,腐蝕主要以點蝕為主;在相對濕度為60%的條件下,腐蝕主要為全面腐蝕;在相對濕度為90%的條件下,腐蝕以全面腐蝕為主并伴隨嚴重的點蝕。
(2)在不同的溫度和濕度條件下,P110SS 鋼表面腐蝕產物膜的致密度和厚度不同。溫度主要影響腐蝕產物膜的致密度,即溫度升高,產物膜致密度下降;濕度主要影響腐蝕產物膜厚度,即濕度升高,腐蝕產物膜厚度增加。
(3)在不同的溫度和濕度條件下,P110SS 鋼的元素硫腐蝕機理不同。在溫度為80℃、相對濕度為60%和90%時,腐蝕的主要原因是S 發生了水解反應,腐蝕產物主要為FeS 和FeSO4;其他實驗條件下P110SS鋼的S 腐蝕主要原因推測是S 直接參與了腐蝕的陰極反應,腐蝕產物主要為FeS。
參考文獻
[1] Mao T. Research on elemental sulfur corrosion and control technology in high sulfur gas fields[D]. Southwest Petroleum University, 2017. (毛汀。 高含硫氣田元素硫腐蝕及控制技術研究[D]. 西南石油大學, 2017.)
[2] Ge P L, Zeng W G, Xiao W W,et al.Effect of Applied Stress and Medium Flow on Corrosion Behavior of Carbon Steel in H2S/CO2 Coexisting Environment[J]. Journal of Chinese Society for Corrosion and Protection,2021,41(02):271-276. (葛鵬莉,曾文廣,肖雯雯,高多龍,張江江,李芳。H2S/CO2 共存環境中施加應力與介質流動對碳鋼腐蝕行為的影響[J].中國腐蝕與防護學報,2021,41(02):271-276.)
[3] Santos J P L, Lobato A K C L, Moraes C, et al. Determination of elemental sulfur deposition rates for different natural gas compositions[J]. Journal of Petroleum Science and Engineering, 2015, 135: 461-465.
[4] Li J L, Zhu S D, Qu Z H, et al. Research Progress on Corrosion of Elemental Sulfur [J]. Hot Working Technology, 2015, 44(2):20-24. (李金靈,朱世東,屈撐囤等。元素硫腐蝕研究進展[J]. 熱加工工藝, 2015, 44(2): 20-24.)
[5] MacDonald D D, Roberts B, Hyne J B. The corrosion of carbon steel by wet elemental sulfur[J]. Corrosion Science, 1978, 18(5):411-425.
[6] Maldonado-Zagal S B, Boden P J. Hydrolysis of elemental sulphur in water and its effect on the corrosion of mild steel[J]. British Corrosion Journal, 1982, 17(3): 116-120.
[7] Schmitt G. Effect of elemental sulfur on corrosion in sour gas systems[J]. Corrosion, 1991, 47(4):285-308.
[8] Wilken G. Effect of environmental factors on downhole sour gas corrosion[C]//CORROSION 96. One Petro, 1996.
[9] Dowling N. Sulfur-related corrosion mechanisms[J]. Corrosion Society, Calgary Section Elemental Sulfur Corrosion and its Mitigation. Calgary: NACE, 2010.
[10] Gee R, Chen Z Y. Hydrogen embrittlement during the corrosion of steel by wet elemental sulfur[J]. Corrosion science, 1995, 37(12):2003-2011.
[11] Yang J Q, Zhang Z H, Zhang C X, et al. Selection and evaluation of low alloy steel for sour service[J]. Chemical engineering of oil & gas, 2014, 43(3): 275-278. (楊建強, 張忠鏵, 張春霞, 等。 低合金鋼抗硫油套管選材與評價方法[J]. 石油與天然氣化工, 2014, 43(3): 275-278.)
[12] Zhang N, Zeng D, Zhang Z, et al. Effect of flow velocity on pipeline steel corrosion behaviour in H2S/CO2 environment with sulfur deposition[J]. Corrosion Engineering, Science and Technology, 2018, 53(5): 370-377.
[13] GB/T 20972.3-2008, Petroleum and natural gas industries—Material for use in H2S-containing environments in oil and gas production—Part 3: Cracking-resistant CRAs (corrosion-resistant alloys) and other alloys[S]. (GB/T 20972.3-2008, 石油天然氣工業 油氣開采中用于含硫化氫環境的材料 第3 部分:抗開裂耐蝕合金和其他合金[S].)
[14] Thomas J M, Adams I, Williams R H, et al. Valence band structures and core-electron energy levels in the monochalcogenides of gallium. Photoelectron spectroscopic study[J]. Journal of the Chemical Society, Faraday Transactions 2: Molecular and Chemical Physics, 1972, 68: 755-764.
[15] Peisert H, Chassé T, Streubel P, et al. Relaxation energies in XPS and XAES of solid sulfur compounds[J]. Journal of electron spectroscopy and related phenomena, 1994, 68: 321-328.
[16] Patterson T A, Carver J C, Leyden D E, et al. A surface study of cobalt-molybdena-alumina catalysts using x-ray photoelectron spectroscopy[J]. The Journal of Physical Chemistry, 1976, 80(15): 1700-1708.
[17] Alt H, Binder H, Sandstede G. Mechanism of the electrocatalytic reduction of oxygen on metal chelates[J]. Journal of Catalysis, 1973, 28(1):8-19.
[18] Tan B J, Klabunde K J, Sherwood P M A. X-ray photoelectron spectroscopy studies of solvated metal atom dispersed catalysts. Monometallic iron and bimetallic iron-cobalt particles on alumina[J]. Chemistry of Materials, 1990, 2(2): 186-191.
[19] Marcus P, Grimal J M. The anodic dissolution and passivation of NiCrFe alloys studied by ESCA[J]. Corrosion Science, 1992, 33(5):805-814.
[20] Li D G, Feng Y R, Bai Z Q, et al. Characteristics of CO2 corrosion scale formed on N80 steel in stratum water with saturated CO2[J]. Applied surface science, 2007, 253(20): 8371-8376.
[21] Paparazzo E. XPS and auger spectroscopy studies on mixtures of the oxides SiO2, Al2O3, Fe2O3 and Cr2O3[J]. Journal of electron spectroscopy and related phenomena, 1987, 43(2): 97-112.
[22] Anwar M, Hogarth C A, Bulpett R. Effect of substrate temperature and film thickness on the surface structure of some thin amorphous films of MoO 3 studied by X-ray photoelectron spectroscopy (ESCA)[J]. Journal of materials science, 1989, 24(9): 3087-3090.
[23] Shuxian Z, Hall W K, Ertl G, et al. X-ray photoemission study of oxygen and nitric oxide adsorption on MoS2[J]. Journal of Catalysis, 1986, 100(1): 167-175.
[24] Caceres C V, Fierro J L G, Lazaro J, et al. Effect of support on the surface characteristics of supported molybdena catalysts[J]. Journal of Catalysis, 1990, 122(1): 113-125.
[25] Bai H T, Yang M, Dong X W,et al.Research Progress on CO2 Corrosion Product Scales of Carbon Steels[J]. Journal of Chinese Society for Corrosion and Protection,020,40(04):295-301. (白海濤,楊敏,董小衛,馬云,王瑞。CO2 腐蝕產物膜的研究進展[J].中國腐蝕與防護學報,2020,40(04):295-301.)
[26] Kruizenga A M. Corrosion mechanism in chloride and carbonate salts[J]. Sandia National Laboratories, Livermore, CA Report No. SAND2012-7594, 2012.
[27] Zheng S, Li C, Qi Y, et al. Mechanism of (Mg, Al, Ca)-oxide inclusion-induced pitting corrosion in 316L stainless steel exposed to sulphur environments containing chloride ion[J]. Corrosion science, 2013, 67: 20-31.
[28] Lindberg B J, Hamrin K, Johansson G, et al. Molecular spectroscopy by means of ESCA II. Sulfur compounds. Correlation of electron binding energy with structure[J]. Physica Scripta, 1970, 1(5-6): 286.
[29] Swartz W E, Hercules D M. X-ray photoelectron spectroscopy of quaternary phosphonium compounds[J]. Analytical Chemistry, 1971, 43(8):1066-1069.
[30] Durbin T D, Lince J R, Didziulis S V, et al. Soft X-ray photoelectron spectroscopy study of the interaction of Cr with MoS2[J]. Surface science, 1994, 302(3): 314-328.
[31] Karthe S, Szargan R, Suoninen E. Oxidation of pyrite surfaces: A photoelectron spectroscopic study[J]. Applied Surface Science, 1993, 72(2):157-170.
[32] Goonasekere K G A. A case study of irrigation water management at Kaudulla irrigation scheme and development of water management alternatives for the dry zone of Sri Lanka[D]. Virginia Polytechnic Institute and State University, 1985.
[33] Seyama H, Soma M. Fe 2p spectra of silicate minerals[J]. Journal of electron spectroscopy and related phenomena, 1987, 42(1):97-101.
[34] Chen T H, Xu L N, Chang W, et al. Effect of Cr Content and Temperature on Corrosion Resistance of Low Cr Pipeline Steel [J]. Natural Gas Industry, 2011, 31(9): 93-97. (陳太輝,許立寧,常煒等。Cr 含量和溫度對低Cr 管線鋼抗CO2 腐蝕的影響[J].天然氣工業, 2011, 31(9): 93-97.)
[35] Lin H C,Yang X Q.Potential phase changes during extraction of very high H2S-bearing gas wells [J]. Corrosion science and protection technique, 1992, 4(4): 308-311. (林海潮, 楊秀清。 特高含 H2S 氣井開采過程中可能發生的相態變化 [J]. 腐蝕科學與防護技術, 1992, 4(4): 308-311.)
[36] Deng T, Ke J J, Chen J Y. Kinetics of Disproportionation of Elemental Sulfur in Aqueous Solutions [J]. Journal Chemical Industry and Engineering, 1984, 4: 328-333. (鄧彤, 柯家駿, 陳家鏞。 元素硫的歧化反應動力學研究[J]. 化工學報, 1984, 4: 328-333.)
[37] Yang L Q. The study of the elemental sulfur corrosion mechanism of X65 pipeline steel under the suspended sulfur environment [D]. Northwest University, 2017. (楊力強。 X65 管線鋼懸浮硫腐蝕機理研究[D]. 西北大學, 2017.)
免責聲明:本網站所轉載的文字、圖片與視頻資料版權歸原創作者所有,如果涉及侵權,請第一時間聯系本網刪除。

官方微信
《中國腐蝕與防護網電子期刊》征訂啟事
- 投稿聯系:編輯部
- 電話:010-62316606-806
- 郵箱:fsfhzy666@163.com
- 中國腐蝕與防護網官方QQ群:140808414





